Napjainkban az őssejt-biológiai kutatások fontos területe lett a madár őssejt-biológia. Cikkünkben bemutatjuk a korai embrionális fejlődés során lejátszódó érdekes embriológiai jelenség, az ivarszervi aszimmetria kialakulásának folyamatát, valamint a madárivarszerv-kezdeményekben, az ivarlécekben megtalálható ősivarsejtek, a PGC-k (primordial germ cells) egyre szélesebb körű alkalmazási lehetőségeit. Modellállatunk a házi tyúk (Gallus gallus domesticus), amely kedvelt kísérleti állat, mivel a madárembriók fejlődésének jelentős része a tojó szervezetén kívül történik, így jól tanulmányozhatók az embriófejlődés lépései egészen az utódok kikeléséig, a megtermékenyülést követő 21. napig.
Hogy kerül az embrió a tojásba?
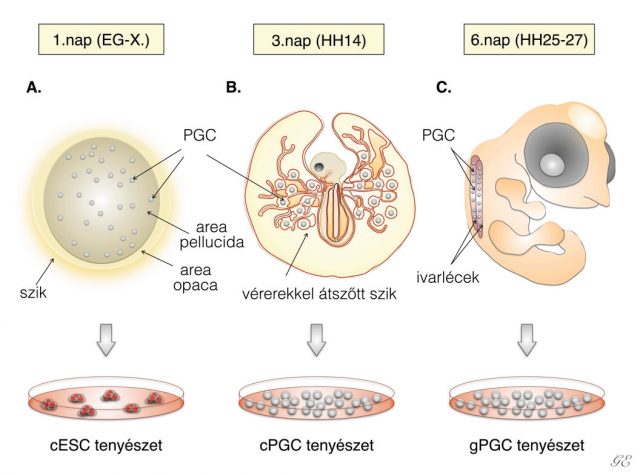
Az embrionális fejlődés a megtermékenyüléssel kezdődik, ami a tölcsérben (infundibulum), a tojó ivari traktusának kezdeti szakaszában megy végbe. A megtermékenyített petesejt ezek után elkezd osztódni, majd a petevezető fehérjetermelő szakaszában (magnum) megkapja az embrió számára későbbiekben fontos tápelemeket. Végezetül a héjmirigyben (méhben) egy vékony mészréteg rakódik rá a tojás külsejére. A tojásrakás pillanatában az embrió az Eyal-Gilaldi és Kochav-féle nevezéktan (Szójegyzék a cikkünk végén található) szerinti X-es stádiumban van (1A ábra). Ekkor körülbelül ötvenezer sejt található a csírakorongban, ezeket a sejteket nevezzük blasztodermális sejteknek. Ezt követően megjelenik a primitív csík, majd a germinális félhold, ahol az ivarsejtek elődjei (prekurzorai), az ősivarsejtek (PG-sejtek) csoportosulnak.
(Az ábrát Gócza Elen készítette)
Ivarszervi aszimmetria
Eltérően az emlősöktől, ahol szimmetrikus ivarszervfejlődés figyelhető meg, a házityúkok esetében a tojóknál jól látható módon a jobb oldali ivarszerv visszafejlődik1–3. A hímeknél ilyen típusú morfológiai aszimmetriát nem figyelhetünk meg. Az aszimmetrikus ősivarsejt-eloszlást a házityúkembriókban elsőként Witschi írta le 1935-ben4. Az aszimmetria csak a tojó egyedek ivarszervei esetében szembetűnő, a hímeknél ez az ivarszervi különbség csak a herékben megtalálható ősivarsejtek számában mutatkozik meg. Ma már tudjuk, hogyan alakul ki ez az aszimmetria. Az ivari elköteleződés előtt még nem látható morfológiai különbség a bal és jobb oldali ivarlécek között egyik nemnél sem5 (2A, 2B ábra). A hím embriónál két, méretében megegyező herét találunk, míg a tojó egyednél csupán a bal oldali petefészek fejlődik funkcionálisan aktív ivarszervvé, a jobb oldali visszafejlődik2 (2C, 2E ábra). Az ivarszerv mind a két ivarnál két részre osztható, a velőállományra (medulla) és a kéregállományra (cortex)2,3 (2B ábra). Az ivarszervek a Hamburger-Hamilton osztályozás szerinti HH35-ös állapottól kezdve mutatnak méretbeli különbséget. Megfigyelhető, hogy a PG-sejtek a petefészek kéregállományában helyezkednek el, míg a hímek esetében a PG-sejtek a heréknek főleg a velőállományában találhatók6 (2D, 2F ábra). Az embrionális fejlődés alatt számos szervnél fellelhető a bal-jobb oldali aszimmetria. Ez összefüggésbe hozható több folyamattal, mint például az embrió fejlődés közbeni elfordulásával, valamint a zsigeri szervek elhelyezkedésével7,8. Megállapították, hogy a Pitx2, illetve a Nodal gének kulcsfontosságú szerepet játszanak a bal-jobb oldali aszimmetria kialakulásban, jelenlétük minden gerinces állat embriójában kimutatható7,9–12. Az aszimmetrikus fejlődés és a jobb oldali ivarszerv degenerációja is összefüggésbe hozható a Pitx2 gén expressziójával13–15. Azon madarak esetében, ahol a tollazat alapján nem lehet az adott egyed ivarát egyértelműen meghatározni, a bal és jobb oldali ivarszervi aszimmetria megléte vagy hiánya segít az ivar meghatározásában. A Szent István Egyetem Vadvilág Megőrzési Intézetében, például az erdei szalonka program keretén belül az ivarmeghatározás a szalonkák ivarszerveinek vizsgálatán alapul.
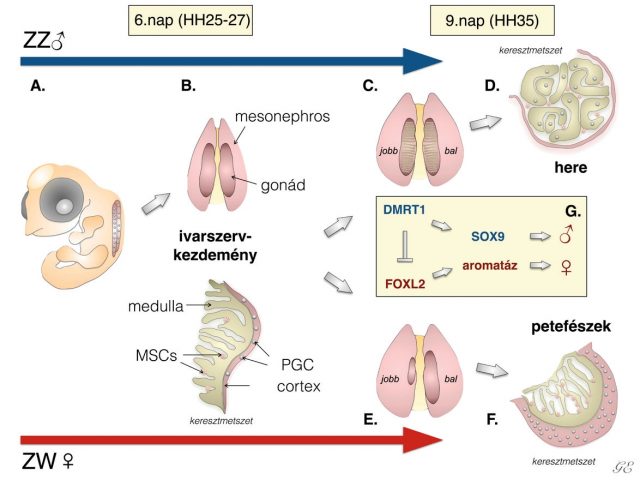
Ivardetermináció
Madarak esetében az ivarszervek fejlődése az embrionális fejlődés 3,5. napján kezdődik el (HH23)16. A legtöbb emlős esetében (beleértve az embert is) és néhány rovarnál (pl. kétszárnyúak, mint a muslica és a házi légy) a nőstény állat a homogametikus (XX) míg a hím a heterogametikus (XY). Eltérően az autoszómáktól és az X kromoszómáktól, az Y kromoszóma csupán egyetlen kópiában található meg a testi sejtekben. Ezzel szemben a madaraknál a tojó egyedek Z és W kromoszómákkal, a hímek két Z kromoszómával rendelkeznek. Az emlősök esetében az X kromoszóma mérete nagyobb, mint az Y kromoszómáé, addig a madarak esetében a Z kromoszóma nagyobb méretű a W kromoszómánál. Az emlősöknél és a madaraknál egyaránt ivari kromoszómához kötött ivarelköteleződést (szexdeterminációt) figyelhetünk meg, viszont a változó testhőmérsékletű gerinceseknél hőmérsékletfüggő ivardetermináció zajlik2. Ezeknél az állatoknál az egyedek neme labilis, könnyen előfordulhat ivarátfordulás is. Kimutatták, hogy az ivar meghatározása a madarak esetében a DMRT1 (doublesex and mab-3-related transcription factor 1) gén feladata. Érdekes módon ez a gén a Z kromoszómán helyezkedik el, s a herében fejeződik ki. A hímeknél ennek a fehérjének a koncentrációja magas a herékben. A DMRT1 gén expressziójának a csökkenése azt eredményezi, hogy a genetikailag hím (ZZ) embrió ivarszervei „elnőiesednek”. A génexpresszió csökkenésével párhuzamosan ezeknél a hímeknél részleges ivarátfordulást figyeltek meg. Az elnőiesedett bal oldali ivarszerv szövettani képe nagyon hasonlított a női petefészekre, valamint a herében jellemzően jelen levő marker, a SOX9 mennyisége is lecsökkent. Az aromatáz – ami egy a petefészekben jelenlevő enzim – viszont aktiválódik a FOXL2 hatására. Az elnőiesedett jobb oldali ivarszerv esetében a DMRT1-expresszió nagyobb mértékben csökkent, ami arra utal, hogy különböző az érzékenység a bal és jobb oldali ivarszerv között a DMRT1 gén expresszióját tekintve. Ezek az eredmények azt igazolták, hogy a DMRT1 gén expressziója szükséges ahhoz, hogy normálisan működő hím ivarszerv fejlődjön ki17 (ZZ (2G ábra). Érdekesség, hogy a természetben találhatók olyan madarak, melyek kevert ivarúak. Ezek az állatok mind a két nem jellemvonásait hordozzák. Leírtak olyan házi tyúkot, aminek a jobb oldala tyúk (ZW) fenotípust, míg a bal oldala kakas (ZZ) jelleget mutatott. Ezeket az állatokat hívják ginandromorf élőlényeknek. Ez a jelenség a házityúknál viszonylag gyakori. Ebben az esetben az egyed teljes értékű hím és női ivarszervekkel is rendelkezik18 (3. ábra). Azt is igazolták, hogy ezeknek az állatoknak minden egyes sejtje egyedi nemi identitással rendelkezik19.

Embrionális őssejttípusok házityúkokban
Embrionális őssejteket (ESC) elsőként az 1980-as évek elején hoztak létre hólyagcsíra állapotú egérembriókból (blasztocisztákból), majd a ’90-es évek második felétől a főemlős, illetve a humán embriókból is sikerült ESC-vonalakat létrehozni20. Az ES-sejtek pluripotensek, mivel a fejlődő magzat minden szövete, szerve, illetve ivarsejtek is létrejöhetnek azokból. A pluripotens őssejtek másik fontos típusa az indukált pluripotens őssejt (iPSC). Az első iPSC-vonal létrehozásáról Yamanaka és kutatócsoportja 2006-ban számolt be21. Az iPS-sejteket testi sejtek visszaprogramozásával hozták létre. Ehhez négy őssejtspecifikus transzkripciós faktort használtak, ezek a c-Myc, Oct3/4, Sox2, Klf4. A későbbiekben ezeket nevezték el Yamanaka-faktoroknak. Az ES-, illetve iPS-sejtek mellett, az őssejtek egy másik nagyon fontos csoportját képezik az úgynevezett őscsírasejtek, (ősivarsejtek, PGC-k). 1992-ben Brigitte Hogan és kollégái az ősivarsejtekkel végzett kísérletek eredményeként arról tudósítottak, hogy közvetlenül őscsíra-sejtekből kiindulva is létre lehet hozni az ES-sejtvonalakhoz hasonló fejlődési képességgel rendelkező sejtvonalakat: ezek az úgynevezett embrionális ősivarsejtvonalak (EGC). Az EG-sejteknek a differenciálódási képessége sok tekintetben megegyezik az ES-sejtekével, azonban számos, az imprinting által érintett gén expressziójának mértéke eltért a normális szinttől22. A madaraknál is többféle őssejtvonalat sikerült létrehozni az elmúlt évtizedekben, ezek közül az embrionális őssejtet, az indukált pluripotens őssejtet és a primordiális őssejtet emelnénk ki. Ezeket az őssejtvonalakat a madár embrionális fejlődésének eltérő stádiumaiban izolálják. Az embrionális, más néven blasztodermális őssejtvonalakat (cESC) a tojás lerakását követően izolált PG-sejtekből lehet létrehozni (1A ábra). A blasztodermális őssejteket a csírakorong területéről gyűjtik össze. Az indukált pluripotens őssejtvonalakat (iPSC) a felnőtt madarak testi sejtjeinek visszaprogramozásával lehet előállítani. Ehhez madarak esetében is a négy Yamanaka-faktort alkalmazzák. A primordiális őscsírasejtvonalakat (cPGC) az embrionális fejlődés 2-3. napján, az embriókból leszívott vérben található PG-sejtekből lehet létrehozni. Ebben az időszakban az őscsírasejtek nagy számban keringenek a madárembriók és a szik érhálózatában (1B ábra). Izolálhatjuk a PG-sejteket hatnapos tyúkembriók ivarszervkezdeményeiből (más néven ivarléc vagy gonád) is, ekkor kapjuk az úgynevezett gPGC-vonalakat (1C ábra).
Ősivarsejtek
A PGC-k az embrionális fejlődés első napján, a csírakorong (blasztodiszk) felületén jelennek meg, majd később az epiblasztban már 30-100 PGC-t találunk. A tojásrakás pillanatában – ekkor az embrió X-es stádiumban van – a csírakorong közepén mutathatók ki a PGC-k23 (1A ábra). A blasztodiszk közepéről a germinális félholdba vándorolnak, közben folyamatosan osztódnak, ami az embrionális fejlődés második napjára körülbelül 300-400 PG-sejtet eredményez. Ezek után a PG-sejtek (HH12-14-es stádium) belépnek az embrió vérkeringésébe2,24,25. A vérben az embrionális fejlődés harmadik napján találhatók legnagyobb számban, ezt nevezzük vándorlási csúcsnak. Ezt követően a PG-sejtek, az embrionális fejlődés hatodik napján, az utóbéli szakasznál, kilépnek a vérkeringésből és bevándorolnak a fejlődő ivarszervekbe.
Embrionális sejttípusból örökéletű kolónia
Az ősivarsejteket a vándorlási csúcs időpontjában célszerű izolálni a madár embriókból, mivel ekkor található a legtöbb PGC az embrionális vérkeringésben, és ekkor a legnagyobb az esély arra, hogy stabil sejttenyészetet, úgynevezett ősivarsejt- (őscsírasejt, PGC) tenyészeteket lehessen létrehozni a kinyert PG-sejtekből. Az embrió dorzális aortáján keresztül, egy mikrokapilláris segítségével izolálható az a hozzávetőlegesen 1-2 mikroliternyi vér, amit a kapillárisból egy speciális tenyésztőoldatba kell juttatni25,26. Az általunk használt sejttenyésztő médiumot a skóciai Roslin Intézet kutatói fejlesztették ki27 primordial germ cells (PGCs). A médium olyan komponenseket tartalmaz, amik a PGC-k osztódását elősegítik, a vérben lévő többi sejt azonban elpusztul. A napi médiumcserékkel ezeket az elpusztult sejteket távolítjuk el a tenyészetekből (4. ábra). A PGC-k segítségével lehetőség nyílik az őshonos, illetve veszélyeztetett baromfifajok/fajták genetikai állományának megőrzésére. Az ivarsejtek prekurzor-sejtjeit, vagyis a PG-sejteket lefagyasztva megőrizhető az adott faj vagy fajta teljes genetikai állománya. Amikor szükség van rájuk, ezeket a lefagyasztott sejteket újra fel lehet olvasztani, tovább lehet azokat tenyészteni, majd ha megfelelő számú sejt áll rendelkezésre, akkor ezeket vissza is lehet injektálni recipiens embriók véráramába. A véráramba visszainjektált PGC-kből a fejlődő embrióban csak ivarsejtek képződhetnek, testi sejtekké nem képesek differenciálódni. Az utódok között lehetnek ivarszervi kiméra egyedek is, így a donorsejt genotípusa átörökíthetővé válik az utódokra (4. ábra).
Kitekintés a jövőbe
Marie-Cecile van de Lavoir és kollégái voltak az elsők, akik elektroporálást végeztek madár embrionális ősivarsejtekbe (cPGC). A létrehozott transzgénikus PG-sejtekből transzgénikus utódokat is elő tudtak állítani28. A génmódosítás napjainkra rutinfeladattá vált. A jövőben egy új módszer térhódítása várható a madár embriológiai- és őssejtkutatások területén is, ez a CRISPR/CAS9-technika, aminek segítségével hatékonyan lehet a célzott géneket kiütni, vagy célzottan módosítani azokat. Ha a tyúk blasztodermális sejteket, ES-sejteket, vagy iPS-sejteket injektáljuk vissza madárembriókba, akkor a fejlődő kiméra embrió minden szövetében – elvétve az ivarsejtjei közt is – megtalálhatóak lesznek a beinjektált módosított sejtekből származó transzgénikus utódsejtek. Amennyiben ivarszervi kimérát szeretnénk létrehozni, akkor a PG-sejtvonalak sejtjeit kell genetikailag módosítani. Ezekből először transzgénikus ivarsejtek képződnek, amelyek tartalmazni fogják a bevitt génkonstrukciót, és ez a módosulás az ivarsejteken keresztül átadódik az utódgenerációra. A transzgénikus házityúk előállításának egyik fontos célja olyan rekombináns humán fehérjéket termeltetni a tyúktojásokban, melyek később a gyógyászatban nagy segítséget nyújthatnak29. Az orvosbiológiai kutatásokban is egyre nagyobb jelentősége várható a tyúk PG-sejteken alapuló modellrendszereknek. Jó példa erre, hogy a házityúkot, mint modellállatot lehet alkalmazni a petefészekrák kialakulásának tanulmányozásában, illetve gyógyításában. A petefészekrák a világon az egyik legelterjedtebb betegség a nők körében. PITX2 transzkripciós faktor túltermelés figyelhető meg a petefészekrák esetében. A PITX2 csak az embrionális korban működő gén. A házityúk esetében megfigyelhető ivarszervi aszimmetria kialakulásában jelentős mértékben részt vesz, és a bal oldali petefészekben jóval nagyobb expressziót mutat mint a jobb oldaliban30. A rákos sejtekben ez a gén nem csendesedik el, így folyamatos működése révén sejtburjánzás következik be. A PITX2 transzkripciós faktort túltermelő tyúkok petefészkének vizsgálata közelebb viheti a kutatókat a petefészekrák kialakulásának megértéséhez, valamint annak visszaszorításához is.
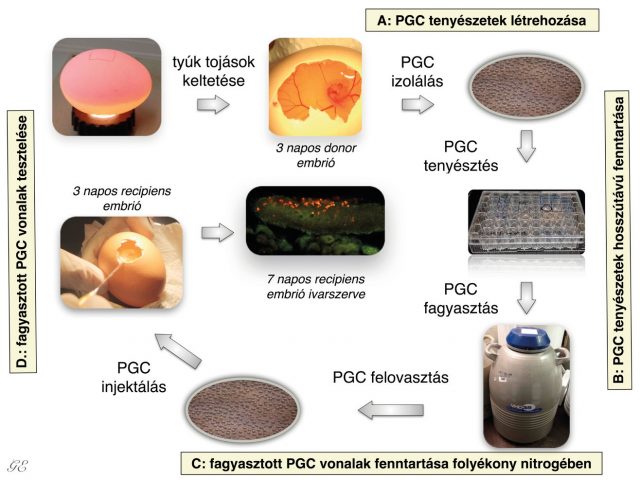
Saját kutatások
A cikk írásában közreműködő kutatók, a Nemzeti Agrárkutatási és Innovációs Központ, Mezőgazdasági Biotechnológiai Kutatóintézetének, Állatbiotechnológiai Főosztálya, Alkalmazott Embriológia és Őssejt Kutató csoportjának munkatársai, több élvonalbeli hazai és nemzetközi őssejtkutató csoporttal állnak munkakapcsolatban. A Haszonállat-génmegőrzési Központ kutatóival együttműködve, „A klímaváltozás lehetséges káros hatásainak mérséklése, alkalmazkodóképesség növelése az agráriumban” elnevezésű nemzetközi tudományos együttműködés (CGIAR CCAFS) programjához kapcsolódó vizsgálataik célja a kelést követő első néhány napon végzett hőkezelés hatásának tanulmányozása volt. Azt vizsgálták, hogyan hat a hőkezelés az ivarérést követően a tojástermelésre, ondóminőségre, valamint mennyiségre, és az embrióelhalásra kendermagos erdélyi kopasznyakú tyúkban, meleg nyári időszak hőterhelésének modellezett körülményei között. Eredményeik azt mutatták, hogy a fiatalkori hőkezelés hatására, a kezelt állatok jóval több tojást tojtak magas hőmérsékleten, mint a kontroll egyedek. Ivarszervi aszimmetria területén is folytatnak kutatásokat. Eredményeik igazolták, hogy bizonyos ivarsejtspecifikus gének nem csak nőstényeknél, de a hímek esetében is jóval magasabb szinten expresszálnak a 6, 8 és 10 napos tyúkembriók bal oldali ivarszervében, mint a jobb oldaliban. A házityúk-őscsírasejtek szövettenyészetben való fenntartása 2006-ban sikerült először, de csak két éve vált lehetségessé egyedi PGC-tenyészetek létrehozása. Hazánkban elsőként a NAIK-MBK őssejt-tenyésztő laboratóriumában sikerült adaptálni ezt a módszert (4. ábra) Más baromfifajok esetében azonban ilyen vizsgálatok egyáltalán nem történtek még. Ezen kutatások végzésére létrehozott konzorcium 2017-ben nyert el egy négyéves támogatást a VEKOP-2.3.2-16-2016-00012 pályázat keretében, „A Kárpát medencei őshonos haszonállatfajok, -fajták és – ökotípusok XXI. századi génbanki stratégiájának tudományos megalapozása és fejlesztése” címmel.
TÓTH ROLAND – LÁZÁR BENCE – GÓCZA ELEN
SZÓJEGYZÉK
Autoszóma: azokat a kromoszómákat, amelyek nem nemi kromoszómák, testi vagy autoszomális kromoszómáknak nevezzük.
Blasztodiszk: a tyúktojás csírakorongja.
CRISPR/CAS9-technika: Jelenleg a legmodernebb genomszerkesztési technika. Lényege, hogy a genomban általunk meghatározott szakaszon képes a DNS-t hasítani, majd a kívánt, új DNS-szakaszt beilleszteni.
DMRT1: (doublesex and mab-3 related transcripton factor 1) a DM domén egy ősi, konzervált része a gerincesek ivarérési útvonalának, ami később egy kulcsfontosságú szabályozó eleme lesz a hím egyedek fejlődésének.
Elektroporálás: nagyfeszültségű, rövid időtartamú elektromos impulzusok használatára alapozott módszer. Elektromos impulzusokkal a sejtek DNS-felvétele fokozható.
Epiblaszt: A belső sejtcsomóból eredeztethető és a hipoblaszt felett helyezkedik el. Az epiblasztból származik az ektoderma, endoderma és a mezoderma, valamint a zsigeri szikzacskó extraembrionális mezodermája, az allantois és az amnion.
Eyal-Gilaldi-féle nevezéktan: Hefzibah Eyal-Giladi és Shimshon Kochav 1976-ban kidolgozott rendszere, mely leírja a tojásban fejlődő embrió stádiumait (római számokkal jelölve).
Germinális félhold: Az a része a fejlődő embriónak, ahol összegyűlnek a PG-sejtek osztódáskor, és innen kezdik meg vándorlásukat az embrió véráramába.
Hamburger&Hamilton stádium: 1951-ben Viktor Hamburger és Howard L. Hamilton készítettek el egy embriófejlődési táblázatot, ahol arab számokkal jelölték az embrió fejlettségét.
Imprinting: a genomi imprinting egy epigenetikai jelenség, mely során gén expressziós változások jönnek létre az utódban a szülők genomja által meghatározott módon.
Ivari determináció: az embrió nemének meghatározása.
NODAL: olyan transzkripciós faktor, amely részt vesz az ivarszerv-aszimmetria kialakulásában.
PGCs, primordial germ cells, ősivarsejtek: Ezek azok a sejtek, melyekből az ivarsejtek fognak képződni a kifejlett állat ivarszervében.
PITX2: Paired-like homeodomain transcriptional factor 2.
Pluripotens: Az extraembrionális réteg kivételével minden sejttípussá képes differenciálódni.
Prekurzorsejt: Elődsejt. Azok a sejtek, melyekből a későbbiekben, differenciálódást követően új sejttípus képződik.
Primitív csík: Egy olyan speciális terület a házi tyúk embrionális fejlődése során, mely a HH2-es stádiumban jelenik meg és fontos szerepet játszik a csíralemezek kialakulásának folyamatában.
SOX9: (SRY box 9 protein) döntő szerepet játszik a hím ivari fejlődésben.
Transzgénikus: Idegen DNS szakaszt (transzgént) tartalmazó genommal rendelkező élőlény, melybe a transzgén beépül, működésre képes, valamint öröklődik is.
Transzkripciós faktor: olyan DNS-kötő fehérjék, amelyek a génátírást szabályozzák. Transz-hatású faktorokként specifikus bázisszekvenciájú DNS-elemekhez kapcsolódnak. A gének alap átírását biztosító általános transzkripciós faktorok, valamint a génregulációt végző szabályozó transzkripciós faktorok ismertek.
Yamanaka-faktorok: Azokat a faktorokat nevezzük Yamanaka-faktoroknak (cMyc, Oct3/4, Sox2 és Klf4), melyek segítségével testi sejteket vissza tudnak programozni őssejtekké. Az így létrehozott őssejteket nevezik indukált pluripotens őssejteknek, röviden iPS-sejteknek.
IRODALOM
[1] Romanoff, A. The avian embryo, structural and functional development. (Macmillan, 1960).
[2] Smith, C. A. & Sinclair, A. H. Sex determination: insights from the chicken. BioEssays 26, 120–132 (2004).
[3] Smith, C. A. & Sinclair, A. H. Sex determination in the chicken embryo. J. Exp. Zool. 290, 691–699 (2001).
[4] Witschi, E. Origin of asymmetry in the reproductive system of birds. Am. J. Anat. 56, 119–141 (1935).
[5] Intarapat, S. & Stern, C. D. Left-Right Asymmetry in Chicken Embryonic Gonads. J. Poult. Sci 51, 352–358 (2014).
[6] Intarapat, S., Stern, C. D., Orme, A., Scotting, P. & Sharpe, P. Sexually Dimorphic and Sex-Independent Left-Right Asymmetries in Chicken Embryonic Gonads. PLoS One 8, e69893 (2013).
[7] Levin, M. Left–right asymmetry in embryonic development: a comprehensive review. Mech. Dev. 122, 3–25 (2005).
[8] Raya, Á. & Belmonte, J. C. I. Left-right asymmetry in the vertebrate embryo: from early information to higher-level integration. Nat. Rev. Genet. 7, 283–293 (2006).
[9] Levin, M., Johnson, R. L., Stern, C. D., Kuehn, M. & Tabin, C. A molecular pathway determining left-right asymmetry in chick embryogenesis. Cell 82, 803–14 (1995).
[10] Belmonte, J. C. I. et al. Pitx2 determines left-right asymmetry of internal organs in vertebrates. Nature 394, 545–551 (1998).
[11] Yoshioka, H. et al. Pitx2, a bicoid-type homeobox gene, is involved in a lefty-signaling pathway in determination of left-right asymmetry. Cell 94, 299–305 (1998).
[12] Zhu, L. et al. Cerberus regulates left–right asymmetry of the embryonic head and heart. Curr. Biol. 9, 931–938 (1999).
[13] Guioli, S. & Lovell-Badge, R. PITX2 controls asymmetric gonadal development in both sexes of the chick and can rescue the degeneration of the right ovary. Development 134, 4199–4208 (2007).
[14] Ishimaru, Y. et al. Mechanism of asymmetric ovarian development in chick embryos. Development 135, 677–685 (2008).
[15] Rodríguez-León, J. et al. Pitx2 regulates gonad morphogenesis. Proc. Natl. Acad. Sci. U. S. A. 105, 11242–11247 (2008).
[16] Guioli, S. et al. Gonadal asymmetry and sex determination in birds. Sex. Dev. 8, 227–242 (2014).
[17] Smith, C. A. et al. The avian Z-linked gene DMRT1 is required for male sex determination in the chicken. Nature 461, 267–271 (2009).
[18] Zhao, D. et al. Somatic sex identity is cell autonomous in the chicken. Nature 464, 237–242 (2010).
[19] Gamble, T. & Zarkower, D. Sex determination. Curr. Biol. 22, R257–R262 (2012).
[20] Lavial, F. & Pain, B. Chicken embryonic stem cells as a non-mammalian embryonic stem cell model. Dev. Growth Differ. 52, 101–14 (2010).
[21] Takahashi, K. & Yamanaka, S. Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell 126, 663–676 (2006).
[22] Matsui, Y., Zsebo, K. & Hogan, B. L. Derivation of pluripotential embryonic stem cells from murine primordial germ cells in culture. Cell 70, 841–7 (1992).
[23] Eyal-Giladi, H. & Kochav, S. From cleavage to primitive streak formation: a complementary normal table and a new look at the first stages of the development of the chick. I. General morphology. Dev. Biol. 49, 321–37 (1976).
[24] De Melo Bernardo, A., Sprenkels, K., Rodrigues, G., Noce, T. & Chuva De Sousa Lopes, S. M. Chicken primordial germ cells use the anterior vitelline veins to enter the embryonic circulation. Biol. Open 1, 1146–52 (2012).
[25] Kagami, H. Perspectives on avian stem cells for poultry breeding. Anim. Sci. J. 87, 1065–1075 (2016).
[26] Intarapat, S. & Stern, C. D. Chick stem cells: Current progress and future prospects. Stem Cell Res. 11, 1378–1392 (2013).
[27] Whyte, J. et al. FGF, Insulin, and SMAD Signaling Cooperate for Avian Primordial Germ Cell Self-Renewal. Stem Cell Reports 5, 1171–1182 (2015).
[28] van de Lavoir, M.-C. et al. Germline transmission of genetically modified primordial germ cells. Nature 441, 766–769 (2006).
[29] Novak, B. J. Advances in Avian Transgenics | Revive & Restore. (2017). Available at: http://reviverestore.org/advances-inavian-transgenics-a-follow-up-to-why-birds-are-a-challenge/. (Accessed: 15th June 2017)
[30] de Melo Bernardo, A. Primordial germ cells and amnion development in the avian embryo. (Department of Anatomy and Embryology, Faculty of Medicine, Leiden University Medical Center (LUMC), Leiden Univ ersity, 2016).
A cikk a Természet Világa 2018. novemberi (149. évf. 11. sz.) számában jelent meg.