A biomarkerek az elmúlt évtizedekben a kutatások középpontjába kerültek, mivel a betegségek megismerése és kezelése céljából elengedhetetlenek. A személyre szabott orvoslás feltétele, hogy legyenek olyan biomarkereink, amelyek könnyen és gyorsan mérhetőek és információt adnak az egyén olyan tulajdonságaira, amely segíthet a hatékony, mellékhatásoktól leginkább mentes terápia kiválasztásában. A neuropszichiátriai kórképek esetén fokozott igény van a biomarkerek kutatására, mert a legtöbb betegségben jelenleg még nincsen jó marker. Ezek közé tartozik a migrén is.
A „biológiai marker” elnevezést 1973-ban kezdték el használni, bár az úgynevezett biológiai jelzőanyagok létezése már korábban is ismert volt. Eleinte csak egy biológiai anyag szervezetben való jelentétét vagy hiányát értették e kifejezés alatt. Jóval később, 2016-ban az amerikai gyógyszerhatóság (FDA) és a Nemzeti Egészségügyi Intézetek (NIH) közösen létrehozott munkacsoportja kibővítette a biomarker definíciót, amely szerint a biomarker olyan tulajdonság lett, amely normális vagy kóros biológiai folyamatok jelzésére, illetve valamilyen beavatkozásra vagy környezeti hatásra adott válasz követésére alkalmas. E megfogalmazás alapján a biomarkereket széles körben alkalmazzák és kutatják azért, hogy szervezetünk működését és a betegségek jellegét jobban megérthessük.
Markerszerepben
Szervezetünk működését alapvetően génjeink határozzák meg. Kézenfekvő gondolat, hogy biomarkerként a betegségek hátterében előforduló genetikai „meghibásodásokat” keressük. A ritka, de súlyos betegségek esetén legtöbbször kimutatható egy vagy több gén mutációja, például a spinális izomatrófia (SMA), más néven gerinc eredetű izomsorvadás az SMN nevű gén hibája miatt alakul ki. Ebben az esetben a genetikai biomarker ismert és könnyen kimutatható, ugyanakkor a gyakoribb, és általában kevésbé súlyos betegségek hátterében nem lehet találni egyetlen jól meghatározható génmódosulást.
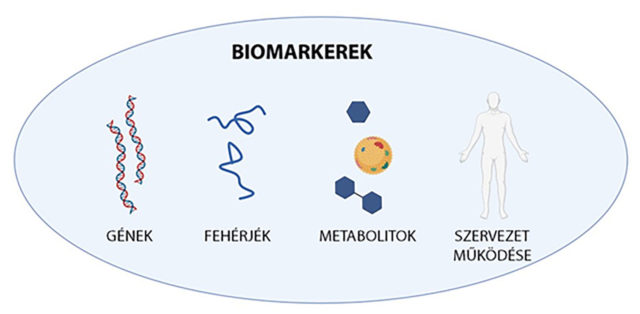
A génekről átíródó fehérjék is lehetnek biomarkerek. Egy általános laborvizsgálat során a C-reaktív protein (CRP) szintjét is ellenőrzik az orvosok, ugyanis a CRP-szintjének emelkedése a szervezetben zajló gyulladásos folyamatokra figyelmeztet. Az emelkedés mértéke pedig utal a probléma súlyosságára, például daganatos megbetegedések esetén a határértéket többszörösen meghaladó CRP-szint mérhető.
A szervezetben található anyagcseretermékek, metabolitok szintén gyakran használhatóak biomarkerként. A vércukorszint rutinszerű mérése a cukorbetegség (diabetes) felismerésére és a betegek állapotának ellenőrzésére szolgál.
Szervezetünk működésének szintjén is találhatunk biomarkereket, bár nem ekként gondolunk rá, de a testhőmérséklet emelkedése, azaz a láz megjelenése szintén valamilyen kóros biológiai folyamatra utal.
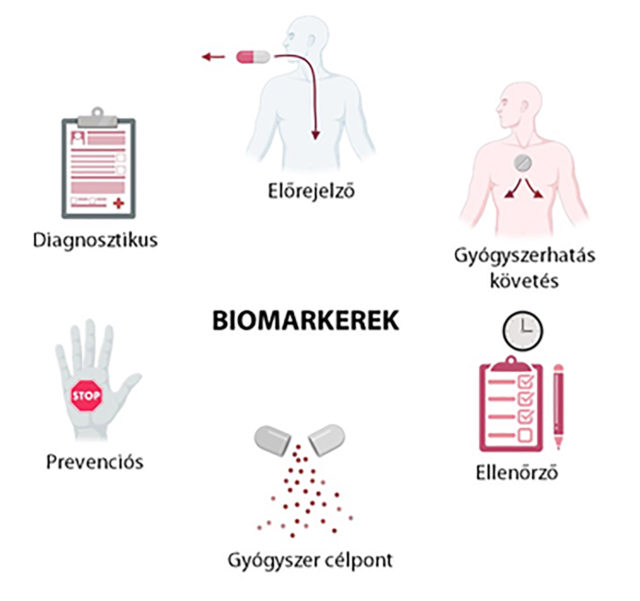
A biomarkereket több célból használják a klinikai gyakorlatban. Az egyik cél a betegség kialakulásának megelőzése, más néven a prevenció. A szív- és érrendszeri betegségek megelőzése érdekében mérik az úgynevezett alacsony sűrűségű (low-density) lipoprotein koleszterin (LDL) szintet rutin laborvizsgálat során.
A diagnosztikus biomarkerek egy betegség vagy állapot fennállására adnak választ. A várandós hölgyek méhlepénye által termelt hormon a humán koriogonadotropin (hCG) az, amelyet a terhességi tesztek gyorsan kimutatnak.
A gyógyszerhatás követésére használandó biomarkerek jelzik a gyógyszeres terápiára adott választ. A vérhígítót (warfarin) szedő betegek rendszeres vérvizsgálaton esnek át, hogy az INR (International Normalised Ratio) értékük a meghatározott 2-3 között legyen. Amennyiben ez az érték alacsony, fokozott véralvadás léphet fel, a gyógyszer hatása nem megfelelő. Az érték feletti szinten pedig túlzott vérhígítás állhat fenn, akkor a spontán kialakuló vérzések kockázata magas.
Az előrejelző biomarkerek képesek megjósolni, hogy az adott egyénre hatással lesz-e egy beavatkozás vagy gyógyszer. A fogamzásgátlók növelik a mélyvénás trombózis kialakulásának esélyét, ami fokozottan igaz olyan nőkre, akik az V. véralvadási faktor mutációja miatt örökletes trombóziskockázatot hordoznak. Ezért a fogamzásgátló szedésének megkezdése előtt javasolt az úgynevezett Leiden-mutáció tesztjének elvégzése, kiszűrve ezzel a nemkívánatos mellékhatást.
Az ellenőrző, más szóval monitorozó biomarkerek egy betegség időbeli változásáról, esetleg egy beavatkozás hatásáról adnak információt. A daganatos megbetegedések esetén a tumor mérete, elhelyezkedése a betegség stádiumait jelzik.
A gyógyszerkutatás és fejlesztés során nagyon fontosak a betegségre jellemző biomarkerek. A kutatók olyan biomarkereket keresnek ebben az esetben, melyek kapcsolatosak a betegség kialakulásával és alkalmas célpontjai lehetnek a betegség kezelésében hasznos gyógyszerek kifejlesztéséhez. Ezek az úgynevezett gyógyszer célpont biomarkerek, amelyeket a migrén esetén is aktívan kutatnak.
A migrén
Egy nemzetközi felmérés alapján az emberek 96 százaléka tapasztal fejfájást élete során, amelyek 90 százaléka elsődleges fejfájás, vagyis önálló betegség (nem egy másik betegség tünete). Ennek több fő típusát különböztetjük meg, ezek közé tartozik a migrén is.
A migrén 4-72 órán át tart, rohamokban jelentkezik, közepes vagy nagyon erős lüktető fájdalom, ami a harmadik leggyakoribb megbetegedés a világon, nőknél 2-3-szor gyakrabban fordul elő, mint férfiaknál. A migrén korlátozza a fizikai teljesítőképességet, a hétköznapi tevékenységeket sokszor ellehetetleníti. E fejfájásban szenvedő egyének a fájdalom mellett hányingert, hányást, fény- és hangérzékenységet is tapasztalhatnak. Az esetek körülbelül egyharmadában aurajelenség is tapasztalható, ami leggyakrabban látótérkieséssel, fényvillanásokkal jár. De akár végtagzsibbadás vagy beszédzavar is jelentkezhet.
Migrénspecifikus gyógyszerek
A migrén egyidős az emberiséggel, de az oka évezredeken át ismeretlen volt, az enyhítésére használható gyógyszerek kifejlesztésére pedig sokáig várni kellett. Először az anyarozs kedvező hatását figyelték meg, melynek hatóanyagát, az ergotamint a mai napig – kisebb módosításokkal – alkalmazzák migrén kezelésére.
A XX. század elején Harold G. Wolff amerikai orvos a migrénes fejfájás során tapasztalható halántékartéria lüktetéséből arra következtetett, hogy az agyi erek tágulása áll a fájdalom hátterében. Ezt a feltételezését igazolta, hogy ha ergotamint adott migréneseknek, akkor a fájdalom csökkenése mellett érösszehúzó hatást észleltek. Tehát az első migrénhez kapcsolódó biomarkernek a halántéktáji artériák fájdalom alatti tágulatát tekinthetjük. A felfedezés után az érösszehúzó anyagok felé fordult a figyelem. A szerotonin mint szintén érösszehúzó hatású anyag a ’60-as években került a migrénkutatás középpontjába. Azt figyelték meg először, hogy a szerotonin fő bomlásterméke, az 5-hidroxi-indolecetsav (5-HIAA) szintje megemelkedik a vizeletben migrénes roham során. Így tehát egy újabb migrénnel kapcsolatos biomarkert azonosítottak a kutatók. Ez adott lökést a későbbi szerotonin alapú migrénspecifikus gyógyszerek kutatásának.
A ’80-as években Patrick P. A. Humphrey, a Glaxo (most GlaxoSmithKline) gyógyszergyár farmakológusa kifejezetten a migrénre ható gyógyszer kutatásába kezdett, ami egy addig ismeretlen perifériás szerotonin receptoron hatva, az agyi erek összehúzódását hozta létre. 1991-ben megjelent a sumatriptan, az első gyógyszer, ami a migrénes roham oldására készült. A betegek csodaszerként emlegették, mivel addig elképzelhetetlen volt számukra, hogy egy kezdődő migrénes roham ne a sötét szobában való fekvésről és várakozásról szóljon. A gyógyszer bevétele után viszont folytatni tudták munkájukat, nem kellett megszakítani a napi tevékenységüket. A fájdalom gyorsan megszűnt és nem fejlődött ki a hányással járó migrén. A sumatriptant még több triptán követte (összesen 7 van jelenleg forgalomban a világon), mely időszakot „triptán forradalom”-nak is neveznek. Több millió ember életét változtatták meg, de végleges megoldást nem nyújtottak a migrén kezelésére. Ugyanis a betegek körülbelül 30-40 százalákánál nem hatnak a triptánok, vagy szív és érrendszeri mellékhatások miatt nem alkalmazhatóak. Ezért a migrénspecifikus gyógyszerek fejlesztése továbbra is kulcsfontosságú kérdés maradt.
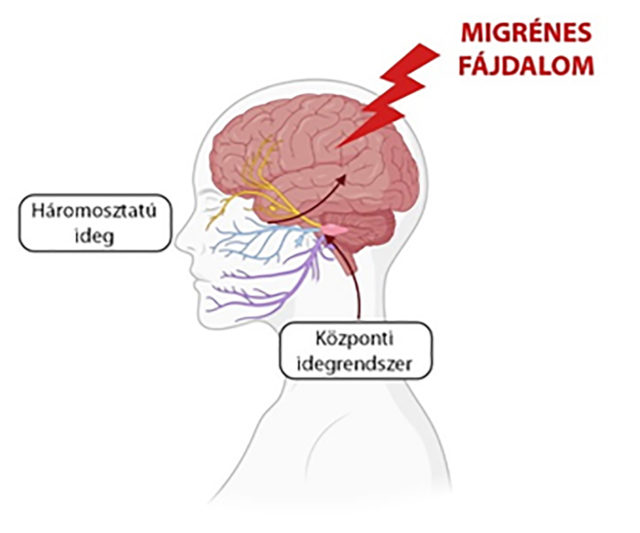
Az orvostudomány fejlődésével egyre inkább nyilvánvalóbbá vált, hogy a migrén nem egy tisztán ér eredetű betegség, hanem a központi idegrendszer külső ingerekre adott fokozott érzékenysége okozhatja. Ugyan hozzájárul az értágulat a migrénes fájdalom kialakulásához, azonban ez nem az okozója, talán inkább a következménye a migrénre való hajlamnak.
A kutatások előrehaladásával kiderült, hogy a migrénben a háromosztatú agyideg fontos szerepet játszik. Emellett több agyi régió eltérő aktivációját figyelték meg a kutatók egy-egy roham során, ami arra utal, hogy a migrén egy rendkívül összetett betegség. Igazán jó agyi biomarkerünk azonban ma sincs a migrén vonatkozásában. Összességében mai tudásunk szerint a migrénes rohamok a központi idegrendszerből indulnak, mely folyamatok érzékennyé teszik a fejet és arcot beidegző háromosztatú agyideget. Ezekben az idegsejtekben fokozódik a gyulladásos és ingerület-átvivő anyagok termelődése, mely hozzájárul az erek tágulatához és a migrénre jellemző erős, gyakran lüktető fájdalom kialakulásához.
A rohamok kialakulását pedig külső tényezők, például a stressz is nagyban befolyásolják. A betegek gyakran számolnak be arról, hogy egy stresszesebb életszakaszban a migrének száma növekszik. Ez azzal magyarázható, hogy az idegrendszer nehezen birkózik meg a külső ingerekhez való alkalmazkodással, túl nagy terhelésnek van kitéve. Később a migrénes fejfájások maguk is jelentősen igénybe veszik az idegrendszert, tovább fokozva a külső ingerekre való érzékenységet. Ez végül egy „ördögi kör”-höz vezet. A stressz fokozza a migrénre való hajlamot, ez utóbbi pedig hozzájárul a stresszel való nehezebb megbirkózáshoz. A szervezet ekkor hiába igyekszik visszaállni az egyensúlyi állapotba, ez egyre nehezebbé válik, ami végül a betegség krónikussá válásához is hozzájárulhat.
Biológiai gyógyszerek migrénben
1982-ben fedezték fel az úgynevezett calcitonin génnel rokon fehérjét (CGRP), mely az érző idegvégződések aktiválódásának hatására szabadul fel a szervezetben és értágító hatást fejt ki. Peter Goadsby és kutatócsoportja a sumatriptan kutatásokkal párhuzamosan, a ’90-es években kimutatták, hogy migrénes roham során a nyaki vénából vett vérben a CGRP szintje megemelkedett és összefüggést mutatott a fejfájás kialakulásával. Ugyanakkor a migrénes roham lecsengésével a CGRP szintje is csökkent. Ez a felfedezés jelentette a CGRP migrén biomarker kutatás kezdetét. Kutatócsoportunknak sikerült kimutatni, hogy a CGRP-szint emelkedése a migrénes roham oldására szolgáló sumatriptan sikeres alkalmazása esetén lecsökken. Tehát a CGRP egy migrénre jellemző biomarker, ami a terápia hatásosságát is jelzi. Ezután kézenfekvő gondolat volt, hogy ha a CGRP-szintet sikerülne gyógyszerekkel befolyásolni, akkor a migrénes rohamot is meg tudnánk előzni. Ezekre a kutatási eredményekre alapozva a 2000-es évek elején kezdődött a CGRP-receptoron ható antagonista anyagok fejlesztése, az úgynevezett gepántoké, aminek eredményeként több gyógyszergyárnak sikerült hatékony gyógyszert fejleszteni a CGRP-receptor ellen. A gepántok ígéretes vegyületnek tűntek, azonban a klinikai tesztek során több típusuk májkárosodást okozott, így jelenleg a mellékhatásoktól mentes típusok kifejlesztésén dolgoznak a gyógyszergyárak.
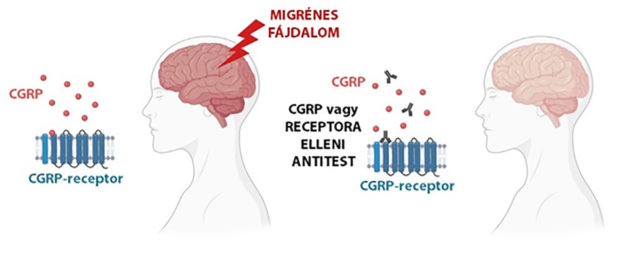
Ezután a kutatók arra gondoltak, hogy a biológiai gyógyszerek fejlesztése lehet a megoldás. A biológiai gyógyszerek élő sejtekből vagy mikroorganizmusokból nyert, általában fehérje típusú hatóanyagok, melyek bizonyos betegségek kezelésére alkalmasak. Így a migrén kezelésére a CGRP-receptor ellen olyan fehérjéket fejlesztettek ki, amik módosításaik révén célzottan képesek megakadályozni, hogy a CGRP bekötődjön a receptorához és kifejtse hatását. Az erenumab, egy CGRP-receptort blokkoló antitest, amit 2018-ban az amerikai gyógyszerhatóság (FDA) első migrénes roham megelőzésére szolgáló specifikus biológiai terápiaként engedélyezett. Ez egy toll formájában kapható injekció, amit 4 hetente kell szúrni, és a más terápiára nem reagáló, krónikus migrénben szenvedő egyének számára jelenthet megoldást. Ezután a kutatások nem csak a receptor ellen, de célzottan a CGRP ellen is kerestek antitesteket, így újabb biológiai gyógyszerekkel bővült a migrén megelőző gyógyszerek sora.
A CGRP felfedezésétől 30 évnek kellett eltelnie, hogy sikeres gyógyszert fejlesszenek ki ellene. Így látható, hogy milyen sok idő szükséges ahhoz, hogy egy ígéretes biomarkerből gyógyszer legyen. De a migrén biomarker és gyógyszerkutatás története még nem ér itt véget. Sajnos, bár ismételt áttörést értek el a migrén megelőzésében és kezelésében az elmúlt évtizedekben, még mindig nagy százalékban vannak olyan betegek, akiknél nem hatnak a jelenleg ismert gyógyszerkészítmények. A kutatások arra világítottak rá, hogy a migrén egy összetett, számos biológiai folyamatot érintő központi idegrendszeri betegség. További biormarkerek keresése pedig elengedhetetlen ahhoz, hogy még sikeresebb és hatásosabb gyógyszereket lehessen fejleszteni azért, hogy még több ember hétköznapjait szabadíthassuk meg a fájdalomtól és a migrénnel járó egyéb kellemetlen tünetektől.
GECSE KINGA – PETSCHNER ANNA – JUHÁSZ GABRIELLA
IRODALOM
[1] Edvinsson L, Haanes KA, Warfvinge K, Krause DN. CGRP as the target of new migraine therapies – successful translation from bench to clinic. Nat Rev Neurol. 2018 Jun;14(6):338-350. doi: 10.1038/s41582-018- 0003-1. PMID: 29691490.
[2] García-Gutiérrez, Maria & Navarrete, Francisco & Sala, Francisco & Gasparyan, Ani & Austrich-Olivares, Amaya & Manzanares, Jorge. (2020). Biomarkers in Psychiatry: Concept, Definition, Types and Relevance to the Clinical Reality. Frontiers in Psychiatry. 11. 10.3389/fpsyt.2020.00432.
[3] Humphrey PP. The discovery of a new drug class for the acute treatment of migraine. Headache. 2007 Apr;47 Suppl 1:S10-9. doi: 10.1111/j.1526-4610.2007.00672.x. PMID: 17425704.
[4] Juhasz G, Zsombok T, Jakab B, Nemeth J, Szolcsanyi J, Bagdy G. Sumatriptan causes parallel decrease in plasma calcitonin gene-related peptide (CGRP) concentration and migraine headache during nitroglycerin induced migraine attack. Cephalalgia. 2005 Mar;25(3):179- 83. doi: 10.1111/j.1468-2982.2005.00836.x. PMID: 15689192.
[5] Singh, Siddharth. (2019). Big Dreams With Big Data! Use of Clinical Informatics to Inform Biomarker Discovery. Clinical and Translational Gastroenterology. 10(3): e00018. doi: 10.14309/ctg.0000000000000018
A cikk a Természet Világa 2020. novemberi számában (151. évf. 11. sz.) jelent meg.



