Mivel helyhez kötött életmódot folytatnak, a növények nem tudnak „elszaladni”, ha valamilyen külső stressz éri őket. Cserébe sejtjeik nagyon gyorsan reagálnak a környezet változásaira, helyreállítva a szöveti károsodásokat. Ennek a feltétele, hogy sajátos struktúrák- a sejtváz- lehetővé tegyék a sejtalkotók gyors alakváltozását és mozgását. Jelen cikk azt vizsgálja, mi történik a sejttel, ha előnytelen hatások érik, és e hatékony dinamika segítségével hogyan javítja ki a károsodást – miként válik a növény újra egészségessé.
Az utóbbi egy-két évtizedben, főleg a lézerpásztázó konfokális mikroszkópia (CLSM) és az élő sejtekben működő fluoreszcens próbákat felhasználó technikák segítségével, teljesen megváltozott az élő sejtekről alkotott képünk. Így ma kis túlzással elmondhatjuk, hogy semmilyen struktúrának nincs meghatározott mérete, alakja és helye a sejten belül – ahogyan ebben a cikkben fogunk is erre példákat látni.
Hogyan jutottunk el ehhez az új szemlélethez? Korábban is lehetséges volt ezeket a struktúrákat nagy felbontásban vizsgálni, akár elektronmikroszkóp, akár az immunhisztokémia segítségével, ez utóbbi főként fluoreszcens mikroszkóp felhasználásával tette láthatóvá a sejtbeni struktúrákat. Ezeknek a módszereknek volt azonban egy komoly hátránya: az élő mintákat először rögzíteni/fixálni kellett ahhoz, hogy tanulmányozni tudjuk. A fixálószerek elölték a sejtet, rögzítették abban az állapotban, amelyben vizsgálni akartuk, ráadásul sok struktúrát eltorzítottak, így azok nem pontosan úgy festettek, mint a valóságban, az élő sejtben. Nagy áttörést jelentett, amikor felfedezték egy medúza zöld fluoreszcens proteinjét (green fluorescent protein, GFP) és megtalálták azt a gént, amely a fehérjét kódolja. Kiderült, hogy a gént az általunk vizsgálni kívánt fehérje génjéhez lehet „ragasztani”, s ha egy adott szervezetbe juttatjuk ezt a hibrid DNS-t, a keletkező, fúziós célfehérje világítani fog az élő sejtben, ha megfelelő hullámhosszú fénnyel gerjesztjük. Ha pedig konfokális mikroszkóppal vizsgáljuk a mintánkat, a fehérje pontos sejten belüli helyét nagy felbontásban látjuk. Ennek a módszernek a segítségével számos struktúrát vizsgálhatunk torzításmentesen, az élő sejtben. Ez teljes sejtalkotókra is vonatkozik. Ha például egy sejtvázhoz kapcsolódó fehérjét „jelölünk meg” ezen a módon, a teljes sejtváz látható lesz (1. ábra). Manapság a GFP sárgán, vörösen vagy kéken világító változatai is elérhetőek, így akár egyszerre több sejtalkotót is vizsgálhatunk ugyanabban a sejtben.
A növényi sejt valódi sejtmaggal rendelkezik, és az eukarióta típusú sejtek többi alaptulajdonságát is mutatja. Jó néhány sajátossága is van. Extracelluláris mátrixa a cellulóz alapú sejtfal, amelyet – amikor még „fiatal”, képlékeny – számos plazmahíd (plazmodezmosz) szel át, megteremtve a kapcsolatot a szöveti kötelékben lévő sejtek között. Ezek a plazmahidak makromolekulák, fehérjék, RNS-ek cseréjére is alkalmasak, mert elég nagy hozzá az átmérőjük. Éppen ezért sajnos a vírusokat is terjesztik egyik sejtről a másikra. A sejtfal, pontosabban az apoplaszt – a sejt plazmamembránon kívüli struktúrái – szintjén számos biokémiai folyamat zajlik, amely a patogénekkel (gombák, baktériumok, vírusok) vagy a kártevőkkel szembeni immunválaszokat váltja ki. Ezzel azonban cikkünk nem foglalkozik, inkább a többi, növényi sajátosságokat mutató sejtalkotóra koncentrálunk. Ezek, amint látni fogjuk, a sejtváz sajátosságai, a sejten belüli membránrendszerek, ezen belül is főleg az endoplazmatikus hálózat és a színtestek, de az eukarióta sejt, „erőművei”, a mitokondriumok szerveződése és működése is különleges.
A növényi sejtalkotók rendkívül dinamikusak, sokkal inkább, mint az állati/emberi sejtekben. Ez azért fontos, mert az állati szervezetek, azon belül a sejtek jó része képes helyváltoztató mozgásra, míg a növények esetében ez meglehetősen korlátozott. Ennek jelentősége van: a sejten belüli fokozott dinamika szükséges ahhoz, hogy maga az egész sejt gyorsan reagáljon a környezet változásaira, legyenek azok biotikus (például patogének) vagy abiotikus (hideg, forróság, vízhiány, magas sótartalom stb.) tényezők. A Debreceni Egyetem TTK Növényi Sejt- és fejlődésbiológia kutatócsoportja is bekapcsolódott ezekbe a kutatásokba, néhány területen hozzá is járultunk a növényi sejt jobb megértéséhez. Jelen cikkben röviden összefoglaljuk, hol is tart ma a növénybiológia ebben a témában. Főként azt fogjuk megvizsgálni, ha egy sejtalkotó károsodást szenved, képes-e azt a növény az intenzív dinamika segítségével kijavítani.
A sejtváz a dinamika felelőse
A növényi sejtben kétféle citoszkeleton struktúra létezik: a mikrofilamentumok (aktinszálak) és a mikrotubulusok. Az állati/emberi sejtekre jellemző átmeneti (intermedier) filamentumokat a növényekben még nem sikerült megtalálni. Ezek a sejtvázelemek mozgatják a sejtalkotókat, irányítják a sejtosztódást, összességében nagyon fontosak abban, hogy a sejt egységes egészként működjön. Oldható, globuláris fehérjék kábelszerű szálakat alkotó polimerjei, amelyek állandóan változnak, összeszerelődnek-szétesnek. A makromolekulákat, sejtorganellumokat motorfehérjék segítségével mozgatják energia- (ATP-) függő módon. A motorfehérjék egyik oldalukon a szállítandó anyagot, a másikon pedig a sejtvázat „fogják meg”.
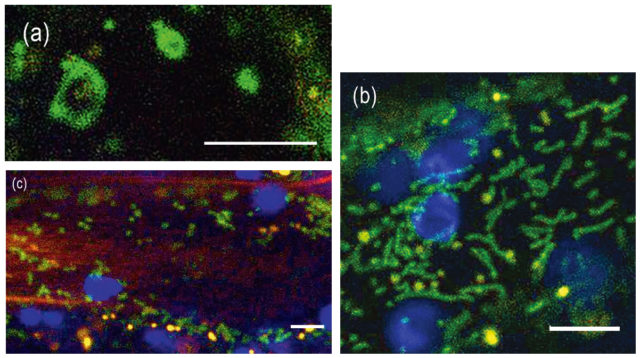
Az aktinszálakat a G-aktin fehérje építi fel. Kötegeik behálózzák az egész sejtet, kapcsolatot tartva a terek között (1. b ábra). Ez azért is fontos, mert növényekben az aktinszálak többféle alkotót mozgatnak, mint más sejttípusokban. Amikor egy patogén megtámadja a sejtet, az aktinszálak vastag kötegeket, „stresszkábeleket” hoznak létre a fertőzés helyén, amelyek makromolekulákat szállítanak, ezek lerakódnak a sejtfalban vastagítva azt, így megakadályozzák, hogy az idegen szervezet szétterjedjen a szövetekben. A normális aktinstruktúra helyreáll, amint a sejt meggyógyul. Hasonló vastag kötegek keletkeznek a vakuólumok közötti vékony citoplazma hidakban (1. a ábra), amelyek megakadályozzák, hogy a vakuólumok idő előtt összeolvadjanak.
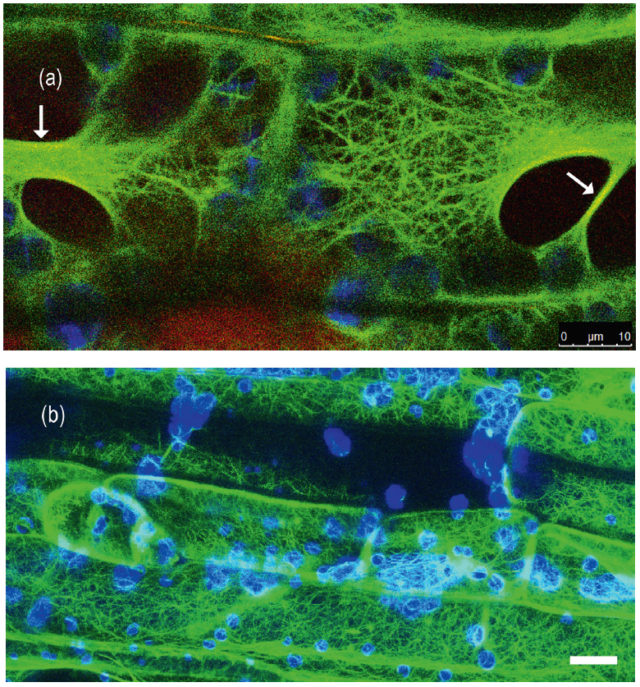
A mikrotubulusok, mint nevük is mutatja, csőszerű „kábelek”, amelyeket két, egymáshoz nagyon hasonlító globuláris fehérje, az α- és a β-tubulin épít fel és egyik fontos szerepük a kromoszómák mozgatása a sejtosztódás idején. Hidegben szétesnek, blokkolva ezzel a teljes sejt működését, de ha a hőmérséklet visszaáll az optimális szintre, gyorsan visszarendeződnek. A növényekben sajátos struktúrákat hoznak létre. Ilyen például a preprofázisos köteg (PPB). Amikor a növényi sejt osztódni készül, a mikrotubulusok a majdani osztódási síkban gyűrűszerű köteggé rendeződnek és meghatározzák a mitózis irányát. Ha külső hatásokra (például bizonyos, élő szervezetek által termelt toxinok miatt) a fehérjeszintézis vagy az auxin nevű növényi hormon transzportja gátlódik, kialakulása zavart szenved, eltorzul az osztódási sík és a teljes osztódó szövet fejlődése. Nincs adatunk arra vonatkozóan, hogy helyreáll-e a PPB, ha ezek a k ülső hatások megszűnnek.
Az endoplazmatikus hálózat
Az endoplazmatikus retikulum (ER) egy, a teljes sejtet behálózó belső membránrendszer (2. a ábra), amely számos funkciót lát el a sejtben, pl. a riboszómákon előállított fehérjék érése itt kezdődik. Cikkünk szempontjából fontos, hogy követi az aktinszálak lefutását és újabban sokan gondolják, hogy képes a citoszkeletonon keresztül mozgatni a sejtszervecskéket. Ezenkívül szinte minden más membránstruktúrával képes kapcsolatot létesíteni, ezzel az életfontosságú fehérjék helyes elosztását segítve a sejtben. Így a citoszkeleton mellett biztosítja, hogy a rendkívül bonyolult eukarióta sejt egységes egészként működjön.
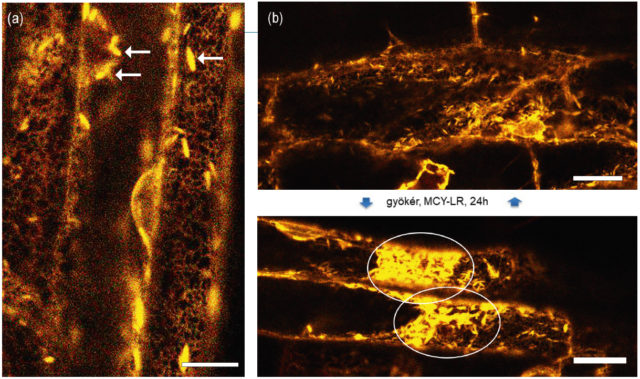
Általános jelenség az úgynevezett ER-stressz. Kedvezőtlen külső hatásokra a sejtben a fehérjék rosszul tekerednek, a helyes fehérjekonformációt biztosító dajkafehérjék már nem képesek hatékonyan ellátni a feladatukat. Ilyenkor a rosszul tekeredett fehérjék az ER-ban halmozódnak fel, egy részük ezután degradálódik. Ha a külső stressz „kezelhető”, és a sejt a kezdeti védekező reakció után fenn tudja állítani normális működését, az ER-ban felhalmozódott „rossz” fehérjék újra normálisan tekerednek (például azért, mert a stressz – akár patogének – hatására a sejt több ER-membránt termel, amelyek több dajkafehérjét fognak tartalmazni), a fehérjék újra felveszik a normális térszerkezetüket és az ER-stressz is megszűnik. Ennek kapcsán mindenképp szólnunk kell az ER-testekről (2. ábra), amelyek úgy tűnik, főként a növényekre jellemző, az ER-membránok helyenkénti tágulásával létrejövő struktúrák. Az ER-testek pontos szerepét még nem értjük, de az tény, hogy stressz hatására képesek felhalmozódni és meghatározott pontokban tömörülni (2. b ábra). Azt is leírták, hogy gombatámadás hatására az ER-testekben a gomba sejtfalát bontó enzimek (β- glükozidázok) halmozódnak fel.
Szoros kapcsolatban
Az ER egy sor membránstruktúra létrehozásában vesz részt. Ezek közül kiemeljük a sajátosan növényi vakuólumokat. Ezeket egy tonoplaszt nevű speciális membrán határolja. A vakuólum kiemelt fontosságú a vízháztartás, a sejten belüli pH szabályozásában és gyakran lizoszómaként viselkedik, a sejthalál során a makromolekulákat bontó enzimekkel telik meg. Ezeket a funkciókat a tonoplaszt rendhagyó felépítése határozza meg – például nagy mennyiségben tartalmaz vakuoláris akvaporinokat, vízszállító fehérjéket, amelyek szárazság idején megkönnyítik a vízfelvételt és gátolják a vízvesztést (a szárazság- és sótűrő növényekben a vakuólumban magas a vizet visszatartó, ozmotikusan aktív anyagok koncentrációja).
Régóta ismert jelenség a plazmolízis: Szárazság vagy a környezet magas sótartalma esetén víz áramlik ki a vakuólumból, majd a sejtből. A vakuólum összezsugorodik, a sejtet csak vékony plazmamembrán felületek, Hecht-fonalak kapcsolják a sejtfalhoz (3. a ábra). Amikor a sejt erős vízvesztés, vagy patogének, toxinok hatására elpusztul, a vakuoláris rendszer szétesik (3. b ábra). Ha azonban a növény ki tudja védeni a kiszáradást, vagy a környezet vízviszonyai újra normálisak lesznek, a vakuoláris rendszer és a teljes sejt működése helyreáll (3. c ábra).
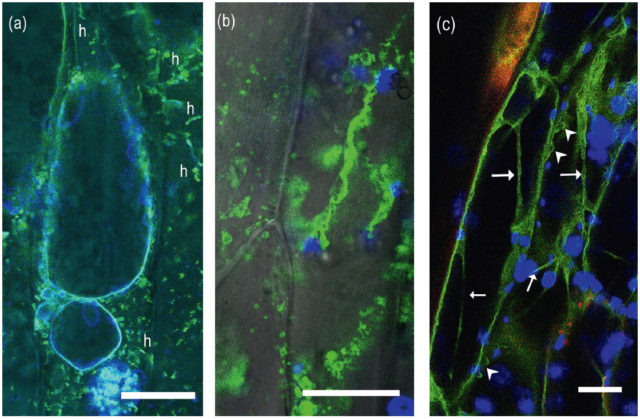
fluoreszcens jelét látjuk). (c) hipokotil sejtek vakuoláris rendszere, amelyet a tonoplaszt GFP-fúziós protein jele mutat. Jól látható, hogy egy sejtben több vakuólum található. A nyilak a vakuólumok közötti citoplazma hidakat, a nyílhegyek a tonoplaszttal határolt kisebb vezikulumokat mutatják. Kék színben a klorofill autofluoreszcenciáját látjuk. Skálák: 20 μm. Máthé Cs. és J. Mathur felvételei.
Régebbi, általánosan elfogadott megfigyelés, hogy a már nem osztódó, differenciálódott sejtben rendszerint egyetlen nagy központi vakuólum található, amely a citoszolt és az organellumokat a sejt perifériájára szorítja. Az újabb élősejt vizsgálatok azt mutatják, hogy nem egészen van így. Ha a tonoplasztot fluoreszcens próbával (például GFP-fúziós fehérjével) jelöljük, kitűnik, hogy gyakran ezekben a sejtekben több, nagyméretű vakuólum található, amelyeket vékony citoplazmahidak választanak el. Mellettük számos, kisebb méretű, tonoplaszttal határolt vezikulum is megfigyelhető (3. c ábra). Ráadásul a vakuoláris rendszer rendkívül dinamikus: a különböző méretű, sokszor eltérő funkcióval rendelkező vezikulumok, a citoszkeleton és az ER miatt állandó mozgásban vannak, egymással összeolvadnak, majd hasadnak. Ez is szükséges ahhoz, hogy a sejt gyorsan reagáljon a külső hatásokra. Ha például a sejt egy makromolekulát vagy sejtorganellumot „halálra ítél”, azt kisméretű vezikulumokba csomagolja, amelyek majd beleolvadnak a nagyobb méretű vakuólumokba, ahol tartalmuk degradálódik.
Az ER-ral membránkapcsolatot létesítő sejtszervecskék közül kiemeljük a plasztiszokat (színtesteket) és a mitokondriumokat. Ne feledjük, evolúciósan ezek a sejtalkotók bakteriális eredetűek. A plasztiszok sajátos növényi sejtalkotók, a fotoszintézis mellett számos egyéb funkciójuk is van. A GFP-fúziós technika segítségével itt is számos újat fedeztek fel. Egyik ilyen izgalmas újdonság, hogy alapállományuk – a sztróma – képes hosszabb-rövidebb nyúlványokat, sztromulákat fejleszteni (4. ábra). Ma még vitatott ezeknek a funkciója, de tény, hogy a stressz képes kiváltani a fejlődésüket (4. a ábra). Ha a sejt védekezni képes, a sztromulákkal rendelkező plasztiszok aránya a normális szintre csökken (4. b ábra). A sztromulák révén a plasztiszok képesek membránkontaktusokat létesíteni az ER-rel (4. c ábra). Mikroorganizmusok által termelt toxinok vagy vírusfertőzés hatására a nyúlványaik révén gyakran a sejtmag köré tömörülnek a színtestek (4. c ábra). Úgy gondoljuk, ilyenkor a növény immunválaszában fontos fehérjék cseréje zajlik a sejtmag/ER és a plasztiszok között.
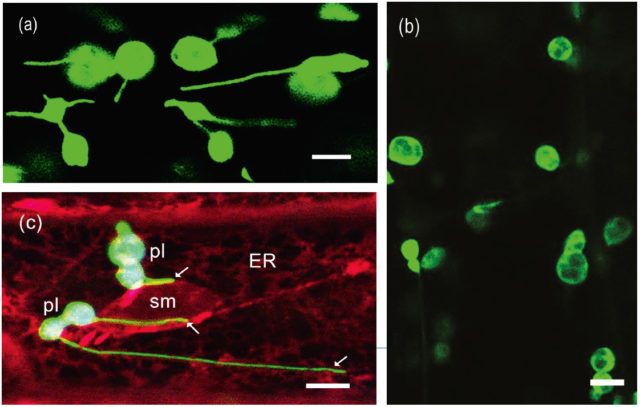
sztromulák révén (nyilak). Skálák: 5 μm. Máthé Cs. és J. Mathur felvételei.
A mitokondriumok az eukarióta sejt erőművei, ATP „gyárai”. Növényekben az aktinszálak mozgatják őket, egyesek szerint az ER membránhálózatán keresztül. Ez a mechanizmus nagyon fontos, mert lehetővé teszi, hogy a mitokondriumok mindig ott gyűljenek össze, ahol nagy az energiaigény (ez az állati sejtekben is így van, például megfigyelték az izmok összehúzódása során az aktin-miozin kapcsolatok helyén). Akárcsak a plasztiszok, ezek is gyorsan és érzékenyen reagálnak a környezet változásaira, hiszen fontosak az oxidatív stressz-szel szembeni védekezésben. Oxigénszegény környezetben (hipoxia hatására) perceken belül változik a morfológiájuk, nagyméretű gyűrű alakot vesznek fel (5. a ábra). A mitokondriumok erősen hajlamosak a hasadásra-fúzióra, amely membránszintű folyamat tehát nem tévesztendő össze a sejtorganellum bakteriális típusú, normál osztódásával. Bizonyos életszakaszokban vagy stressz hatására a mitokondriumok hosszú, pálcika alakú struktúrákká olvadnak össze (5.b ábra) és a mobilitásuk erősen csökken. Ha a sejt kivédi a külső hatásokat, morfológiájuk és működőképességük gyorsan helyreáll (5. c ábra).
A sejtváz és az ER irányítja tehát a növényi sejten belül tapasztalható erős dinamikát, amely lehetővé teszi a sejtalkotók rendeltetés-szerű elosztását. Ez nemcsak a sejt normális működése, de az előnytelen külső hatások kivédése szempontjából is fontos.
MÁTHÉ CSABA
Nyitókép: Máthé Zsófia és Kolozsvári Noémi rajza
A cikk a Növényi Egészség Éve alkalmából kiírt cikkpályázatunkon I. díjat nyert.
IRODALOM
[1] Baskin, T. (2015) The cytoskeleton, in: Buchanan, B.B., Gruissem, W., Jones, R.L. (szerk.) Biochemistry and molecular biology of plants. Wiley-ASPB, pp. 191-238.
[2] Caplan, J.L., Kumar, A.S., Park, E., Padmanabhan, M.S., Hoban, K., Modla, S. és mtsai (2015) Chloroplast stromules function during innate immunity. Developmental Cell 34: 45-57.
[3] Mathur, J. (2004) Cell shape development in plants. Trends in Plant Science 9: 583-590.
[4] Mathur, J. (2007) The illuminated plant cell. Trends in Plant Science 12: 506-513.
[5] Nagy, M., Kéki, S., Rácz, D., Mathur, J., Vereb, G., Garda, T. és mtsai (2018) Novel fluorochromes label tonoplast in living plant cells and reveal changes in vacuolar organization after treatment with protein phosphatase inhibitors. Protoplasma 255: 829-839.
A cikk a Természet Világa 2021. januári számában (152. évf. 1. sz.) jelent meg.





