A médiában gyakorta hallani a genetikáról mint az orvostudomány egy rohamosan fejlődő ágáról, amely egy nap majd gyógyírt jelenthet az olyan pusztító kórságok ellen, mint például a rákos megbetegedések. Kevesebb szó esik azonban a genetikai kódunk kifejezésében kulcsszerepet játszó epigenetikáról. A genetika szó a görög genesis, azaz „eredet” szóból származik és az öröklődés törvényeivel foglalkozik. Az epigenetika pedig a genetikai törvényeken kívüli – szó szerint azon felüli – öröklődés és szabályozás tudománya.
A genetikai kódunkat a DNS (dezoxiribonukleinsav) tárolja. A DNS-molekula egy hosszú, csaknem 2 méteres lánc a milliméter század részében összecsomagolva, de elég stabil ahhoz, hogy képes legyen időtállóan megőrizni a sejtjeink működése számára nélkülözhetetlen információt. Az RNS (ribonukleinsav) egy általában sokkal rövidebb láncú és bomlékonyabb molekula, így információ tárolására csak korlátozottan alkalmas, azonban a sejten belüli és a sejtek közötti kommunikációra tökéletesen megfelel. Végül, a genetikai kódunk kifejeződése a rendkívül változatos funkciójú fehérjékben nyilvánul meg. A szervezetünkben végbemenő folyamatokat túlnyomórészt a fehérjéink alakítják. Nélkülük nincs élet. Hogyan függ össze ez a három láncszem?
A kódtól a fehérjéig
A DNS, életünk kódját a bázisainak sorrendjében tárolja. Ezek a bázisok az adenin (A), guanin (G), citozin (C) és timin (T). Minden, földi élethez szükséges információt A, G, C, T, illetve az RNS esetében T helyett az uracil (U) bázisok sorrendje kódolja, írja le. Ha az emberi DNS-t könyvként, bázisait pedig annak betűiként szeretnénk nyomtatásban viszontlátni, akkor ehhez körülbelül egy 725 kötetnyi 1000 oldalas könyvre lenne szükségünk. Ennyi információ szükséges az élethez, ennyi információ szükséges a 3 milliárd bázis betűjének leírásához.
A DNS-ünk kétszálú spirálként fogható fel, tehát amit eddig bázisként említettem, azok valójában bázispárok: A-nel szemben T vagy U, G-nal szemben mindig C foglal helyet. Most már beláthatjuk, hogy a DNS hogyan képes ennyi adatot tárolni. Ahhoz, hogy ebből az adatból élet legyen, szükséges meghatározni az adatokban rejlő információt. Az ember esetében itt jön képbe az RNS. Egy izgalmas és a gyakorlatban általam is „kihasznált” folyamat során a DNS egyik láncának egy meghatározott részét különböző enzimek (enzim: kedvezőbb feltételeket teremt az általa katalizált reakcióknak) lemásolják, és egyfajta RNS-tükörkép formájában lehetővé teszik ennek az információnak az eljuttatását a megfelelő helyre. Itt az információt hordozó RNS az elképesztően gazdag funkcióval bíró fehérjék tervrajzaként szolgál.

A fehérjék – az örökítőanyaghoz hasonlóan – építőelemek egymásutánjaiból épülnek fel, az: aminosavakból. A bázissorrendből aminosavsorrend, azaz fehérje lesz. Eljutottunk tehát az adatoktól az információn keresztül egészen a tudással, pontosabban funkcióval bíró molekulákig. Az életet leíró kód tehát a DNS-ben kapott helyet, ahonnan szükség esetén az RNS által előhívható, amely fátuma végeztével hamar le is bomlik, így precízen beállítva a keletkező fehérjék mennyiségét is. A folyamat iránya, tehát DNS – RNS – fehérje (1. ábra).
Legalábbis sokáig ezt hittük…
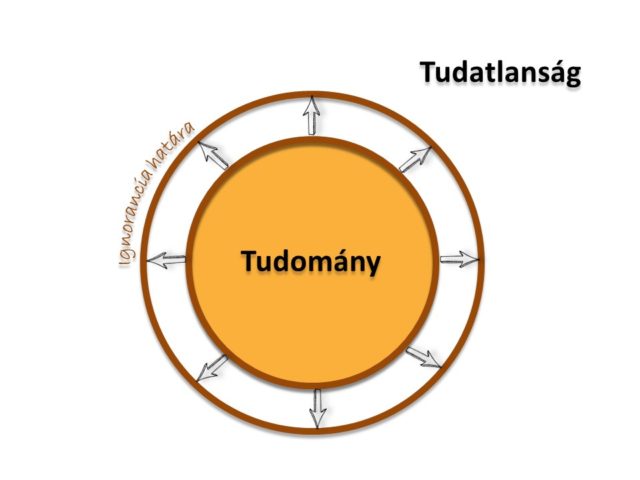
Félreértés ne essék, tudtuk, hogy az RNS képes örökítőanyagként vagy akár enzimként is működni, azonban az evolúció ezen feladatok túlnyomó részét mégis inkább a sokkal stabilabb DNS-re és a sokkal változatosabb felépítésű fehérjékre bízta. A meglepetés akkor ért minket, amikor felfedezték, hogy a DNS-ünk 90 százalékáról képződő RNS-ek csupán 1-2 százaléka kódol fehérjét! A maradék 98-99 százalékról egyszerűen el sem tudtuk képzelni, hogy milyen funkciót tölthet be. Mellékterméknek, „hulladék-DNS”-nek neveztük az örökítőanyagunk csaknem 9/10-ed részét. Akkoriban ez a durva megállapítás a biológusok körében nagy port kavart, sőt egyesek szerint a kutatók szerénytelenségéről tettek tanúbizonyságot. Óva intenék azonban mindenkit az efféle kijelentésektől – akár örökítőanyagról, akár kutatókról legyen szó – hiszen, ahogy növekszik a tudásunk „területe”, úgy nő vele az ignoranciánk, tudatlanságunk „kerülete” is (2. ábra). Pontosan ez történt ezen új tudás birtokában is és ez történik minden egyes új felfedezés, minden egyes PhD-kutatás alkalmával. Az új információ kiszélesíti a tudás és tudatlanság között húzódó határt és nem könnyű észrevenni, hogy következtetéseinkkel épp melyik oldalon álltunk meg. Alapszabály, hogy legyünk tekintettel a másik oldalra is – bárhol is álljunk – így figyelmet biztosítva a felfedezésünknek ellentmondó érveknek is.
Az imént említett ellentmondó érveknek hála foglalkozhatom ma a nem-kódoló RNS-ek szerepével a PhD-kutatásom során.
Az RNS-ek befolyása
A nem kódoló RNS-ek az epigenetikai szabályozás részei, a DNS bázissorrendjének megváltoztatása nélkül fejtik ki hatásukat a képződő fehérjékre és befolyásolják a DNS működését is. Szerepüket tekintve egyelőre még feltárás alatt álló anyagok, amelyek szervezetünk működésének szinte minden jelentős folyamatában jelen vannak. Így például kulcsszerepet játszanak a sejtciklus és differenciálódás, illetve sejtproliferációnak nevezett mechanizmusokban, amelyek mind a sejtek szövetté, szervekké való alakulásának, az egyedfejlődésnek a lépcsői. Részt vesznek továbbá a hormonelválasztásban, a vérképzésben és zavart képződésük esetén hozzájárulnak a tumorképződéshez, szív- és érrendszeri, valamint az autoimmun betegségekhez is.

Civilizált társadalmunk legelszomorítóbb adatai a tumoros betegségeket övezik. Ahhoz, hogy a gyógyításban és a gyógyulásban egyenrangú partnerei legyünk a daganatos megbetegedéseknek, szükséges azt időben felismerni és pontosan tudni, hogy mely szervből indul ki. Mindez lehetőleg egy egyszerű vérvételből kimutatható legyen. A terápia tervezése során ideális, ha egyrészt tudjuk a terápia nélkül várható kimenetelt, a prognózist, másrészt a prediktív markerek (olyan anyagok a szervezetben, amelyekből következtetni tudunk egy betegség lefolyására, viselkedésére) segítségével képesek legyünk előre jelezni egy adott kezelés sikerességét, adott esetben a terápiaváltás szükségességét (3. ábra). Ezen kérdések foglalkoztattak leginkább, amikor úgy döntöttem, hogy témavezetőm segítségével a nem kódoló RNS-ek egy speciális fajtáját, a cirkuláris RNS-eket fogom kutatni a még a tumorok között is rendkívül szomorú mutatókkal rendelkező mellékvesekéreg-rákok tekintetében.
Rákterápiás lehetőség
Tulajdonképpen milyen okok vezetnek a rák kialakulásához? Miből alakul ki egyáltalán? Utóbbira egyszerű a válasz: saját, előzőleg egészségesen működő sejtjeink alakulnak át. A daganatok olyan elfajult, gyorsan osztódó sejtjeink, amelyeket az immunrendszerünk valamiért nem képes észlelni és elpusztítani.
Daganat bármely sejtünkből kialakulhat. Nem szerencsés tehát az a fogalom, amely úgy kezdődik, hogy „a rák…”, hiszen a rosszindulatú megbetegedések nagyon eltérőek. „A rák ellenszerére” sem szabad várnunk, hiszen daganattípusok százait foglalja magában ez a gyűjtőnév. Annyira változékonyak, hogy egy beteg egy daganatán belül is egyidejűleg számos különböző molekuláris mintázattal rendelkező daganatos sejtvonal húzódhat meg. A különböző molekuláris mintázat különböző áttétet adó képességet, terápiára adott választ, túlélést jelent a beteg szempontjából. Sajnos egyelőre képtelenek vagyunk valamennyi típusra egyszerre tüzelni. Egyenként kell hatástalanítanunk őket.
Visszatérve az első kérdésre, arra sokkal nehezebb választ találni. A daganatokat ma genetikai, epigenetikai eredetű megbetegedéseknek gondoljuk. A gyors egymás utáni sejtosztódások a DNS gyors egymás utáni másolatkészítését is jelentik, azonban, ha siettetik, a sejt nem képes kijavítani az osztódás során keletkezett hibákat és azt továbbadja a következő generációnak. A sok daganatsejt sok genetikai hibája közül a nagy számok törvénye alapján lesz, amelyik éppen olyan mutációt, azaz a DNS-sorrendben történő cserét hordoz, amellyel képes elkerülni az immunrendszert és zavartalanul osztódhat tovább. Ha ez a sejttömeg elég nagy lesz vagy elég sok hormont vagy más anyagot termel, akkor megjelennek az első tünetek. Fogyás vagy épp hízás, vérszegénység, láz, fáradékonyság vagy más specifikusabb tünetek, mint például hosszú ideje nem múló viszketés, vérnyomás-kiugrások, vizenyő, szakadékony bőr stb. A beteg orvoshoz kerül, és ezzel kezdetét veszi a tumorkutatás.
A tumort kutató orvoscsapat lelki szemei előtt különböző genetikai hátterű és molekuláris motívumokkal bíró daganatok jelennek meg. Mindezek tisztázására a patológus képes, egy-egy szövettani minta segítségével. A daganat bázissorrendjének, epigenetikai és egyéb molekuláris mintázatának adataiból az orvoscsapat információhoz jut. Ez az információ a meghatározott végzettségű szakemberek tudása által döntési lehetőségekké alakul, amelyeket a beteggel vállvetve beszélnek át. PhD-munkám során célom a mellékvesekéreg-daganatok diagnózisának és kiértékelésének ezen folyamatához további információt szolgáltatni, amely hosszú távon további döntési-, vagy akár terápiás lehetőséget is kínálhat a betegek részére.
Jellemző mintázat
A patológusokhoz hasonlóan én is szövetminták feldolgozásával kezdtem a munkámat. Ezek legnagyobb ellensége az oxigén, ami a levegő 21 százalékát alkotja, ezért mihamarabb fixálási folyamaton esnek át a minták konzerválás céljából. Az általam keresett cirkuláris RNS-ekben ez a folyamat is képes kárt tenni, azonban sokkal kisebb mértékben, mint az egyéb nem cirkuláris RNS-ekben, épp ezért alapozhattuk ilyen mintákra a kutatásunkat. Az első lépésben speciális oldószerek segítségével visszanyertük az eredeti mellékvesekéreg-szövetet. A szövet DNS-ét és fehérjéit elbontottuk (érdekesség, hogy ehhez is egy fehérjealapú enzimet használtunk), majd a már RNS-t tartalmazó oldatot eltettük -80 °C-ra, ahol az alacsony hőmérséklet fogja hosszú távon tovább konzerválni a bomlékony molekuláinkat.
A következő lépésekben sorban szabadultunk meg azoktól az RNS-ektől, amelyekre egyáltalán nem volt szükségünk. A módszer nehézsége, hogy a teljes RNS-állomány alig 1 százalékát alkotják a cirkuláris RNS-ek. Egy háromlépcsős folyamat során (1. nem cirkuláris RNS emésztése, 2. „adeninfarok” rákapcsolása a cirkuláris RNS-re, 3. timin mágneses elvonás) végeredményben mintegy „kihalásztuk” a már csak pikogrammos mennyiségben jelenlévő cirkuláris RNS-t.

Ebben a tartományban a rugós ellenállású konyhamérleg helyett már az anyagunk fényelnyelő képességét és egyéb fluoreszcens jelölőanyagokat használtuk a pontos méréshez. Megfelelő mennyiség birtokában a következő lépésekben az RNS-molekulákról, ezúttal visszafelé haladva DNS-molekulát készítünk speciális enzimek segítségével, hiszen a szekvenáló géppel csak a DNS bázissorendjét tudjuk lemérni. Ehhez – szintén megfelelő enzimek hozzáadásával – ideális méretűre vágjuk és elektromos kölcsönhatáson alapuló mágnesezhető vasszemcsékbe áztatjuk a kapott örökítőanyagot. Az utóbbit a folyamat során többször is el kell végezni a termék megtisztítása céljából. A különböző minták DNS-eit, különböző molekuláris jelölőkkel látjuk el, ezáltal lehetővé válik a szekvenáló gépben megjelenő adatok egyes mintákhoz való rendelése, ami elengedhetetlen a konklúzió levonásához. Mielőtt betennénk a gépbe a reakcióelegyet, még szükséges azt felsokszorozni egy PCR-nek (polimeráz láncreakció) nevezett módszerrel, amely nem különbözik a SARS-CoV-2 kimutatására is használt PCR-alapú teszteléstől. Ezek után a rendelkezésünkre álló nagy adatmennyiséget elemezve következtetéseket tudunk levonni a tumoros és nem tumoros mellékvesekéreg cirkuláris RNS-mintázatáról, illetve eredményeinket újabb patológiai mintákon fogjuk tudni validálni (4. ábra). PhD-munkám további szakaszában a mindennapi diagnosztikában már könnyen hozzáférhető vérmintákban és vizeletmintákban is szeretném kimutatni e betegek cirkuláris RNS-profiljának zavarát.
Minden PhD-dolgozat a jelenlegi tudásunk területét hivatott bővíteni, azonban megjósolhatatlanul hosszú évek munkája lehet, amíg az adatainkból információ az információból tudás a tudásból pedig egy új döntési lehetőség, irányelv születik. A tudomány és a tudatlanság határán átlépve – amely folyamatot kutatásnak nevezünk – szükségünk van egy hipotézisre, amelyet meg lehet erősíteni/cáfolni. A munka eredménye tudományos közlemények formájában kerül rögzítésre. Amennyiben több független, akár rivális munkacsoport is hasonló eredményre jut, majd a bizonyítékok tömegét egymással összehasonlítva ésszerű következtetéseket lehet levonni, akkor már nem hipotézisről, hanem elméletről beszélünk. Az evidencia egy újabb szintre lépett, a tudomány határa kitágult körülötte. Az elméletből ezután gyakorlat, irányelv és természetesen új frontvonal bontakozhat ki a jövő kutatásai számára. Azt hiszem, mi PhD-hallgatók ebben a tudományos rengetegben akarunk egy nyomot hagyni, amely talán majd vezet valahova. Mindannyian más módszerekkel, különböző témát kutatva, változó elszántsággal és lehetőségekkel, de mégis, ugyanabban a rengetegben.
TURAI PÉTER ISTVÁN
Az írás a TIT és a DOSZ ismeretterjesztő cikkpályázatán III. díjat nyert.