Ahogy Louis Pasteur mondta: „A végtelenül kicsinek végtelenül nagy a szerepe”. A baktériumok már évmilliárdokkal az emberiség megjelenése előtt benépesítették bolygónkat, szerepük vitathatatlan a jelenlegi ökoszisztéma kialakulásában és fenntartásában. Egy új tudományterület, a mikrofluidika megjelenésével olyan eszközök kerültek a kutatók kezébe ezen lények tanulmányozására, amelyekkel eddig nem ismert tulajdonságaik vizsgálhatók.
Baktériumok minden földi élőhelyen megtalálhatók, számuk nagyságrendileg 5 kvintillió (5 x 1030) [1]. A néhány mikrométeres egysejtűek bár a legegyszerűbb élőlények, bizonyos körülmények között mégis összetett, fejlett viselkedést mutatnak. A természetben gyakran alkotnak bonyolult, jól szervezett közösségeket, melynek során szoros fizikai és (bio)kémiai kölcsönhatásban állnak környezetükkel, illetve más mikroorganizmusokkal. Ezek a kölcsönhatások alapvetően befolyásolnak olyan folyamatokat, mint például a biofilmképzés vagy az antibiotikumokkal szemben való ellenállóképesség kialakulása, ezáltal a bakteriális fertőzések létrejöttében is fontos szerepük lehet. Ahhoz, hogy ezeket a kölcsönhatásokat a laboratóriumban is tanulmányozhassuk, újszerű módszerekre van szükség. A hagyományos mikrobiológia ötvözése a legújabb mikrofluidikai technológiával forradalmasította az ilyen irányú kutatásokat.
Mi is az a mikrofluidika?
A mikrofluidika parányi folyadéktérfogatok (10-9-10-18 liter) manipulálásával (keverés, áramlás) foglalkozó multidiszciplináris tudományterület és a hozzá kapcsolódó technológia. A mikrofluidikai berendezésekben a folyadékok áramoltatását és szabályozását mikroszkopikus méretű csatornák, csövek, kamrák, szelepek és pumpák biztosítják. Az ilyen rendszerek egyik fontos jellemzője, hogy a folyadékok csatornákban történő áramlása során a felület/térfogat hányados arányosan nő a méretek csökkenésével, és az áramlástani jellemzők is drasztikusan megváltoznak. A legfontosabb különbség, hogy makroszkopikus rendszerekben, melyekkel a mindennapi életben is sokszor találkozunk, a folyadékok turbulens áramlást mutatnak, míg mikrocsatornákban úgynevezett lamináris (réteges) áramlás alakul ki. A mikroszkopikus mérettartományokban emiatt a folyadékok viselkedése rendkívül pontosan megjósolható, modellezhető, és olyan jelenségek is vizsgálhatók, melyek a makroszkopikus rendszerekben láthatatlanok. Az eszközökbe sejteket is juttathatunk, és vizsgálhatjuk, hogyan reagálnak különböző oldatok, vegyi anyagok, vagy más sejtek megjelenésére.
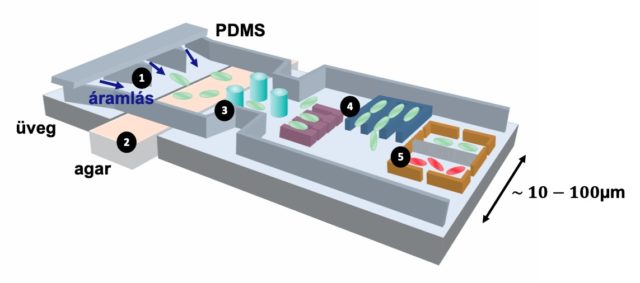
Az első mikrofluidikai eszközök szilíciumalapúak voltak, mivel az elektronikai ipar módszereivel állították őket elő. Később megjelentek a jól megmunkálható, rugalmas polimerek is. Ma az egyik legnépszerűbb alapanyag a polidimetilsziloxán (PDMS), mely egy optikailag átlátszó, gázokra permeábilis, biokompatibilis szilikongumi. Használata nagyon egyszerű. Egy öntőforma elkészítése után költséghatékonyan állíthatunk elő sorozatban mikrofluidikai eszközöket, kezdve egyetlen csatornától/kamrától egészen az összetettebb rendszerekig, melyek beépített szelepeket, mérőelektródokat is tartalmazhatnak. Az egyik első biológiai alkalmazása ennek a technológiának egy folyamatos baktériumtenyésztést biztosító kemosztátrendszer volt miniatűr méretben, melynek egésze elfér egy pénzérme felületén (1. ábra) [2].

A mikrobiológiai kutatások szempontjából sok új irányvonalat hozott a mikrotechnológia [3,4]. A 2. ábrán látható, hogyan is kell elképzelni egy ilyen PDMS alapú mikrocsipet. Lehetőség van porózus anyagok (például gélek, membránok) beépítésére, fizikai akadályok (falak, oszlopok) kialakítására, egyedi sejtek csapdázására és hosszútávú megfigyelésére, vizsgálhatjuk populációk kölcsönhatását, de akár evolúcióját is. A Szegedi Biológiai Kutatóközpont Biofizikai Intézetében ezekkel az eszközökkel tanulmányozzuk a környezet változékonyságának szerepét a baktériumközösségek életében, különös tekintettel a kommunikációra, populációk versengésére és az antibiotikum rezisztencia kialakulására.
Társas lények közösségben
Bár hajlamosak vagyunk a baktériumokra mint önálló, magányos sejtekre gondolni, kifejezetten társas lényekről van szó, melyek a természetben közösségek formájában élnek. Bizonyos alapvető szociális viselkedési formák, mint például az együttműködés és a versengés általánosan elterjedtek a mikrobaközösségek életében. Talán a legegyszerűbb példa erre egy adott élőhely tápanyagforrásaiért folytatott versengés és azokon való osztozkodás. Az együttműködés egyik formája, hogy egy baktériumpopuláción belül az egyedek összehangoltan termelnek a közösség számára fontos javakat, amiből aztán mindenki egyformán részesül. Egy tipikus, közismert példa az együttműködésre és a munkamegosztás megnyilvánulására a háromdimenziós biofilmstruktúrák kialakulása és működése. Ezek a „baktériumvárosok” egymáshoz kapcsolódó sejtek tömegéből állnak, melyek között feladatmegosztás (különböző vegyületek termelése, tápanyagok továbbítása stb.) biztosítja az egész közösség optimális működését.
A baktériumközösségeknek életét nagymértékben befolyásolják a környezeti tényezők. A kutatólaboratóriumokban lombikokban nevelt baktériumkultúrák korántsem tapasztalják ugyanazt, mint például a talajban vagy az emberi emésztőrendszerben élő mikrobaközösségek. A mikrofluidika segítségével kicsit közelebb kerülhetünk a természetes viszonyokhoz. Többek között vizsgálhatjuk azt, hogy különféle stratégiákat alkalmazó baktériumfajok közösségei hogyan alkalmazkodnak a más-más környezeti feltételekhez és egymás jelenlétéhez. Juan E. Keymer kutatócsoportjával (University of Aysén, Coyhaique, Chile) együttműködésben egy mikrocsipben utánozzuk a környezet térbeli összetettségét, és vizsgáljuk, hogy annak milyen szerepe lehet abban, hogy különböző mikroorganizmusok képesek együtt/egymás mellett élni [5].
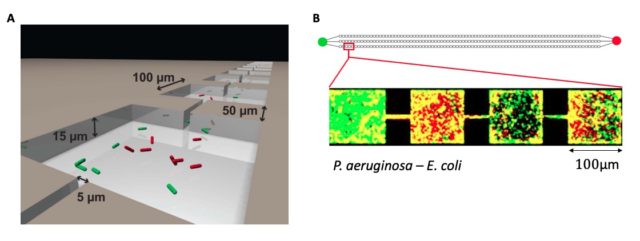
Az eszköz kamrák láncolatából áll, amiket keskeny csatornák kötnek össze egymással (3. ábra). Hasonlóan strukturált (de persze bonyolultabb) élettér előfordulhat például a talajban is, ahol a talajszemcsék között kis kamrák alakulnak ki. A különböző baktériumok eltérő módon népesítik be ezt a kamrarendszert. A kiválóan úszó Escherichia coli előbb feltérképezi a környezet egészét, és egyenletesen benépesíti azt. Ezzel szemben a szintén jól úszó, de amellett felületekhez tapadásra hajlamos, és nagyon erősen biofilmet képező Pseudomonas aeruginosa a felületre tapadt, és a folyamatosan osztódó baktériumtömeg egy hullámban folyamatosan halad előre kamráról kamrára. Ha ezt a kétfajta baktériumot „összeengedjük”, versenyeztetjük ebben az eszközben, azt tapasztaljuk, hogy P. aeruginosa nagymértékben elnyomja az E. coli populációt, de nem szorítja ki azt teljesen az élettérből. Kis csoportosulásokban, jellemzően a kamrák sarkaiban, az E. coli is megmarad és képes túlélni a P. aeruginosa mellett. Ez az agresszív biofilmképzés, és az ennek hátterében álló kommunikációs stratégiák miatt a P. aeruginosa fertőzése meglehetősen komoly problémákat tud okozni az egészségügy számára is.

Ezeknek a közösségeknek az együttélése során kiemelkedő szerep tulajdonítható a baktériumok által termelt kommunikációs jelmolekuláknak, toxinoknak és anyagcsere-melléktermékeknek. Ezek jelenlétére, illetve hiányára sokféle módon reagálnak a baktériumok. A kémiai anyagoknak az érzékelése és a sejtválasz kétféle módon valósulhat meg. Az egyik esetben a baktériumok a kibocsájtott molekulák mennyiségét, koncentrációját mérik, és arra reagálnak. A másik esetben nem elég pusztán az inger jelenléte, hanem a koncentráció térbeli változására (koncentrációgradiensre) reagálnak a sejtek. A koncentrációgradiens jelenlétét csupán a mozgásra képes mikroorganizmusok tudják érzékelni. A sejtek mozgásuk során folyamatosan detektálják egyes vegyületek koncentrációjának változását, és ez befolyásolja mozgásuk további irányát. Ezt a folyamatot nevezzük kemotaxisnak.Az abszolút koncentráció mérésére egy nagyon jó példa a quorumérzékelés, mely a bakteriális kommunikáció egy speciális formája. A „quorum” szó magyarul szavazóképes létszámbeli állapotot jelent, és arra utal, hogy ez a típusú kommunikáció egyfajta közösségi, összehangolt válaszreakciót fog eredményezni a populáción belül. Lényege, hogy léteznek olyan „közös javak”, amik csak bizonyos sejtszám felett használhatóak ki, akkor, ha kellően nagyszámú, egymáshoz közeli baktériumegyed szinkronizáltan termeli azokat. A baktériumok jelmolekulák termelésével és érzékelésével képesek megállapítani, hogy szükséges számban vannak-e jelen. Ezt a típusú kommunikációt használja több fertőzést okozó baktérium is. A fentebb említett opportunista patogén P. aeruginosa így szabályozza biofilmképzését és néhány egyéb folyamatot is. Egy jellegzetessége ennek a baktériumnak, hogy bizonyos körülmények között egy felületaktív anyagot termel, amin aztán a baktériumok mintegy csúszva haladnak előre (4. ábra). Emellett, a fertőzéshez nélkülözhetetlen virulenciafaktorok termelése is sejtszámhoz kötött, hiszen kevés baktériummal könnyen elbír egy egészséges immunrendszer. Magát a quorumérzékelés jelenségét először a Vibrio fischeri biolumineszcens baktériumfajnál fedezték fel, ami egy tengeri élőlénnyel, a kurtafarkú tintahallal (Euprymna scolopes) él szimbiózisban. A tintahal tápanyagokkal látja el a fényszervében élő baktériumokat, ezáltal biztosítva számukra a zavartalan osztódást, és anyagcserét. A baktériumok pedig fénykibocsátásukkal „segítik” a tintahalat éjszakai vadászata során, ami így a felülről besütő Hold fényét és helyzetét képes utánozni. Így a tintahal körvonalai tökéletesen beleolvadnak a környezetbe, és a táplálékot jelentő leendő áldozatok nem veszik észre. A tintahal fényszerve, ahol a baktériumok élnek, csak abban az esetben világít, ha a baktériumok úgy érzékelik, elegendő számban vannak jelen. Kevés sejt esetén ugyanis az erőforrásigényes fénytermelés nem lenne elegendő az álcázásra, a baktériumok feleslegesen pazarolnák energiájukat. A vele együtt élő baktériumok számát és ezáltal a „lámpájának” ki/be kapcsolását az állat úgy tudja szabályozni, hogy a felesleges sejttömeget egyszerűen ledörzsöli a hasáról, illetve kis mértékben az elfogyasztott táplálék mennyiségével is befolyásolhatja a baktériumpopuláció méretét.
Tájékozódás az összetett környezetben
A baktériumoknak egy jelentős része mozgásra képes. Mozgásuknak nagy szerepe van abban, hogy tájékozódni tudjanak egy összetett, bonyolult környezetben és megtalálják a számukra kedvezőbb életkörülményeket. Kemotaxis során az úszó baktériumok folyamatosan érzékelik a számukra fontos kémiai vegyületek (például tápanyagok) koncentrációját, és mozgásuk irányát eszerint változtatják (például a tápanyagforrás irányába). Bizonyos tanulmányok szerint a motilitásnak a fertőzőképesség szempontjából is fontos szerepe van. Nem véletlen tehát, hogy a bakteriális kemotaxis az egyik legalaposabban tanulmányozott biológiai érzékelő rendszer.

Laboratóriumunkban létrehoztunk egy kemotaxis-vizsgálatra alkalmas eszközt, melynek segítségével vizsgálhatjuk, hogy bizonyos baktériumok „mennyire szeretik egymás társaságát” (5. ábra) [6,7]. Az eszközben két baktériumpopulációt egy vékony membrán választ el egymástól. Ezen a membránon a baktériumok nem jutnak át, de az általuk termelt kémiai anyagok (kommunikációs jelzőmolekulák és anyagcseretermékek) igen. A jelmolekuláknak a jelenlétét, pontosabban a belőlük kialakuló kémiai gradienst érzékelik a szomszédos populáció sejtjei. Mikroszkóppal tudjuk követni azt, hogyan viselkedik ebben az eszközben két egymástól elválasztott E. coli populáció. Mint az az ábrán is látszik, annak ellenére, hogy egy bizonyos ideig szeretnek a sejtek ugyanott tartózkodni, mint a másik baktériumpopuláció, és élvezik ugyanannak a tápanyagforrásnak a használatát, egy bizonyos idő után mégis eltávolodnak onnan. Ennek magyarázata, hogy olyan anyagcseretermékek (például indol) jelennek meg nagy koncentrációban, melyek elűzik onnan a sejteket. Az ilyen anyagokat repellenseknek nevezzük. Természetesen az eszköz segítségével a baktériumokat egy helyre vonzó (attraktáns) anyagok is azonosíthatók, de akár gyógyszerek koncentrációfüggő hatása is vizsgálható. Nagyobb nagyítást használva az egyes sejtek úszását is követhetjük, megmérhetjük az általuk megtett pálya hosszát, amiből a sebességük kiszámolható. Az E. coli baktérium átlagos úszási sebessége 20-30 μm/s, ami azt jelenti, hogy saját sejthosszának körülbelül tízszeresét teszi meg másodpercenként. Ez a sebesség természetesen változhat különböző körülmények között. Kutatócsoportunkban például kimutattuk, hogy nagydózisú antibiotikum jelenlétében lényegesen lelassulnak ezek a baktériumok.
Új kihívás: az antibiotikum-rezisztancia
Az antibiotikumokkal szembeni ellenállóképesség (rezisztencia) nagymértékű terjedése komoly kihívást jelent az egészségügy számára. A mikroorganizmusok genetikai változások, mutációk segítségével képesek alkalmazkodni és túlélni a számukra kedvezőtlen körülményeket. Ezt az általában lassan lezajló folyamatot nagymértékben felgyorsítja a különféle antimikrobiális szereknek az emberiség által növekvő, sok esetben indokolatlan használata. Egyes tanulmányok szerint ebben a folyamatban fontos szerepet játszik, hogy az antibiotikumok eloszlása nem egyenletes a baktériumsejtek környezetében. Az emberi szervezet esetében például az egyes szervekben, szövetekben különböző koncentrációkban halmozódnak fel gyógyszerek, mely kémiai gradiensek kialakulásához vezethet. Mikrofluidikai eszközökkel könnyen modellezhető egy ilyen összetett környezet és annak a hatása a bakteriális evolúcióra.
A témában az egyik úttörő tanulmány Robert Austin kutatócsoportjához (Princeton University, USA) fűződik [8,9]. Létrehoztak egy 1200 kamrát és ezeket összekötő csatornahálózatot tartalmazó mikrofluidikai rendszert, ahol az antibiotikum diffúziós keveredését kihasználva egy speciális eloszlást hoztak létre. Az alkalmazott antibiotikum különböző koncentrációkban van jelen a kamrákban, egyes részek antibiotikummentesek, míg máshol akár a halálos dózis százszorosa is megtalálható. Elrendezésüket a 6. ábra szemlélteti. A baktériumok szabadon mozoghatnak az eszközben, megkereshetik a számukra legkedvezőbb körülményeket.
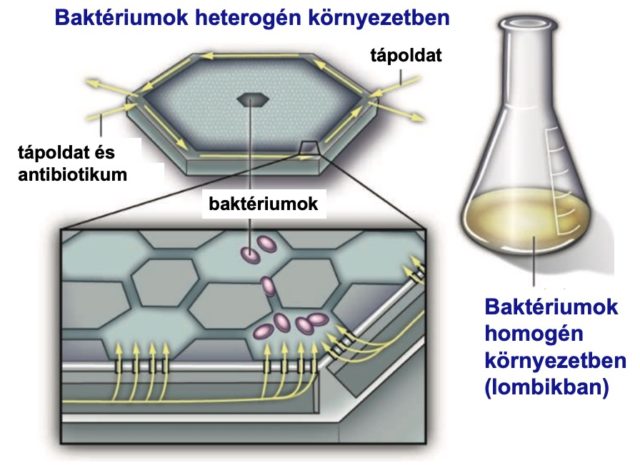
Az ellenálló törzsek megjelenése és szaporodása pedig mikroszkópiával követhető. A megközelítés egyedi, hiszen korábban a laboratóriumban végzett evolúciós kísérletek lombikokban zajlottak, ami egy homogén környezetet jelent. Az „Austin-labor” kísérletei alapján egy ilyen heterogén környezetben már néhány órán belül megjelennek és elkezdenek szaporodni az antibiotikumnak ellenálló mutáns baktériumpopulációk. Lombikban történő nevelés esetén hasonló mértékű antibiotikum rezisztencia kialakulása hetekben mérhető.
Laboratóriumunkban vizsgáljuk annak a lehetőségét, hogy elegendő-e pusztán az antibiotikum koncentrációjának egyenetlen térbeli eloszlása ahhoz, hogy hasonlóan gyorsan megjelenjenek és elszaporodjanak az antibiotikumnak ellenálló baktériumok. Ehhez a fentebb (5. ábrán) bemutatott, két kamrából és egy csatornából álló mikrofluidikai eszközt használjuk olyan módon, hogy az eszközben található legnagyobb antibiotikumkoncentráció jóval meghaladja azt a dózist, ami halálos az adott baktérium számára. Az eszközben egyenletesen változik az antibiotikum-koncentráció egy baktériumokat tartalmazó mikrocsatorna szélessége mentén.
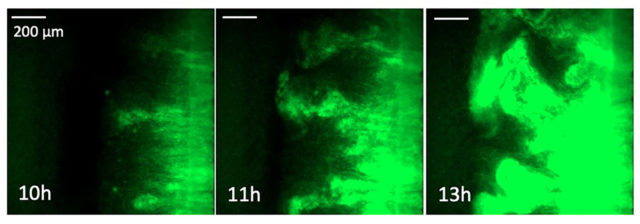
(A szerző felvételei)
Kísérleteink során többféle antibiotikumot is teszteltünk. A sejtek osztódását gátló ciprofloxacin és a baktériumok sejtfalának szintézisét gátló ampicillin esetében hasonló jelenséget tapasztaltunk. Mindkét esetben csupán fél napba telik, hogy megjelenjenek olyan ellenálló sejtek, amelyek aztán a nagydózisú területeket is gyorsan benépesítik (7. ábra). Néhány nap alatt pedig jelentősen megemelkedik a rezisztenciája ezeknek a sejteknek. Ez azt jelenti, hogy a korábban hatásos antibiotikum-dózis már nem elegendő elpusztításukhoz, helyette annak akár 10-20-szorosát kell alkalmazni. Ennek a rezisztenciának hátterében új mutációk megjelenése áll. A ciprofloxacin esetében ez a következőképpen néz ki. Ez az antibiotikum a baktériumok osztódását akadályozza meg olyan módon, hogy egy enzim (DNS-giráz) működését gátolja, aminek szerepe a felcsavarodott DNS-szálak szétválasztása. Amennyiben ez nem történik meg, akkor sérül a DNS megkettőződése és a fehérjék átírása is, tehát a baktérium osztódásra képtelenné válik. Az általunk végzett kísérletek arra utalnak, hogy a néhány nap alatt kialakuló rezisztenciáért sok esetben a DNS-giráz enzim génjében kialakuló mutáció felelős, melynek eredménye az enzim olyan szerkezeti változása, mely meggátolja az antibiotikumot hatásának kifejtésében.
A cikkben részletezett példák jól illusztrálják, hogy a mikrofluidikai csipek a baktériumok kutatásának hatékony új eszköztárát jelentik. Segítségükkel összetett, a természetben előforduló élethelyzetek hozhatók létre a baktériumok számára a laboratóriumban is. Így a sejtek mozgása, kommunikációja, együttélése és evolúciója is új nézőpontból tanulmányozható.
NAGY KRISZTINA
KÖSZÖNETNYILVÁNÍTÁS
A bemutatott, részben jelenleg is folyamatban lévő kutatások elvégzését több pályázati forrás is segíti (NKFIH PD 124889, K116516). A szerző munkáját a Magyar Tudományos Akadémia Bolyai János Kutatási Ösztöndíja (BO/00463/18/8) és az Innovációs és Technológiai Minisztérium ÚNKP-19-4 számú Új Nemzeti Kiválósági Programja is támogatja.
IRODALOM
[1] Whitman et al. (1998) Prokaryotes: The unseen majority, Proc. Natl. Acad. Sci. USA, 95. 6578-6583.
[2] Balagaddé et al. (2005) Long-term monitoring of bacteria undergoing programmed population control in a microchemostat, Science, 309. 137-140.
[3] Nagy et al. (2018): Application of microfluidics in experimental ecology: The importance of being spatial, Front. Microbiol., 9. 496.
[4] Rusconi et al. (2014) Microfluidics expanding the frontiers of microbial ecology, Annu. Rev. Biophys., 43. 65-91.
[5] Hol et al. (2013) Spatial structure facilitates cooperation in a social dilemma: empirical evidence from a bacterial community, PLOS ONE, 8. e77042
[6] Nagy et al. (2014) Interaction of bacterial populations in coupled microchambers, Chem. Biochem. Eng. Q., 28. 225-231.
[7] Nagy et al. (2015) Microfluidic study of the chemotactic response of Escherichia coli to amino acids, signaling molecules and secondary metabolites, Biomicrofluidics, 9. 044105
[8] Zhang et al. (2011) Acceleration of emergence of bacterial antibiotic resistance in connected microenvironments, Science, 333. 1764-1767.
[9] Frisch és Rosenberg (2011) Antibiotic resistance, not shaken or stirred, Science, 333. 1713-1714.