A prion és az emlékezet
Mint arról 1998. januári számunkban részletesen
beszámoltunk, az 1997. évi élettani és orvosi
Nobel-díjat Stanley B. Prusiner, a San Franciscó-i Kaliforniai
Egyetem professzora kapta a fertõzõ szivacsos agyvelõsorvadással
vagy ismertebb nevén: prionbetegséggel kapcsolatos kutatásaiért
és alapvetõ felismeréseiért. Elmélete
középpontjában az a meghökkentõ és
sokáig kétkedéssel fogadott feltételezés
áll, hogy e halálos kimenetelû betegség hátterében
nem valamilyen ismert patogént baktériumot, vírust
vagy gombát kell keresnünk, hanem csupán egy szokatlan
szerkezetû fehérjét. Az elmúlt csaknem két
évtized kutatásai a fehérje okozta betegség
elméletét fényesen igazolták a fehérjét
prionnak nevezték el , de szinte egyáltalán nem adtak
választ arra a kérdésre, hogy mi a prionfehérje
hétköznapi funkciója, vagyis milyen szerepet játszik
szervezetünk mindennapi mûködésében. Ez a
fehérje ugyanis mindannyiunk szervezetében (idegrendszerében)
megtalálható, és általában semmiféle
bajt nem okoz. Írásunk azt az elképzelést ismerteti,
amely szerint a prionfehérje tartós információtárolásra
képes, így a memóriafolyamatokban játszik szerepet.
A fertõzõ szivacsos agyvelõsorvadás olyan, halálos kimenetelû neurodegeneratív betegségcsoport, amelynek ismertek fertõzõ, öröklõdõ, és az egészséges népességben kis valószínûséggel, elszórtan megjelenõ sporadikus formái. A legismertebbek: a szarvasmarhákat sújtó szivacsos agyvelõgyulladás (BSE), a juhokat érintõ surlókór (scrapie) és az embert veszélyeztetõ CreutzfeldtJakob-betegség (CJD). A közelmúlt vizsgálatai alapján egyértelmûen kijelenthetjük, hogy a betegségek hátterében mindig az egészséges állatokban és emberekben is megtalálható prionfehérje szerkezeti változása áll [1]. A fehérje megváltozott szerkezetének az a rendkívüli tulajdonsága, hogy képes megsokszorozódni, vagyis betegséget nem okozó normális szerkezetû társait a maga képére formálni. Ezen autokatalitikus tulajdonság miatt a fehérje szerkezeti átalakulása pozitív visszacsatolást mutat, és így a megváltozott szerkezet a hagyományos patogénekhez hasonlóan szaporodni és fertõzni képes. A szerkezetváltozás kiváltó oka lehet a patológiás szerkezetû prionfehérje egészséges szervezetbe történõ véletlen bejutása (fertõzés), a fehérje mutációja (örökletes formák), illetve nagy ritkán az egészséges forma spontán átalakulása (sporadikus formák). Az autokatalitikus szerkezeti átalakulás pontos molekuláris megértése a prionbetegségekbe való terápiás beavatkozás és a sikeres kezelés lehetõségét ígéri, ugyanakkor elképzelésünk szerint közelebb vihet bennünket a prion hétköznapi funkciójának megértéséhez is.
Elméletünk szerint a prionfehérje hétköznapi funkciójában ugyanúgy a szerkezeti flexibilitás és az autokalitikus szerkezeti átalakulás játszik szerepet, mint a betegségek kialakulásában; ez a képesség a fehérjét azzal a tulajdonsággal ruházza fel, hogy tartós információhordozó legyen, és így memóriafolyamatokban játszhasson szerepet.
 |
| 1. ábra. Hosszú távú információtárolás:
molekuláris kapcsolók. Az ábra olyan molekuláris elrendezéseket mutat, amik molekuláris kapcsolóként mûködnek: egy kezdeti jel (stimulus) hatására meg- változott állapotukat elvileg akármeddig megtartják, és így nagyon hosszú távon képesek információt tárolni: A) autofosz- forilációs kapcsoló, B) fehérjeexpressziós kapcsoló, C) fehérje-konformációs kap- csoló. A pozitív visszacsatolást minden esetben szaggatott nyíl jelzi. |
A prionfehérjét (a szakirodalom tanúsága szerint) eddig jobbára mint betegséget okozó részecskét patogént vizsgálták, normális funkciójának megértését nem sok kísérleti munka tûzte ki célul. Ez az aránytalanság azt a képzetet keltheti, hogy a fehérjének nincs is más funkciója, mint hogy a szervezetet megbetegítse, ami természetesen képtelenség, s nagyon ritkán is fordul elõ. A sejtjeinkben egész életünk során megtalálható fehérje feltétlenül szerepet játszik szervezetünk mindennapi mûködésében is, és a patológiás szerep feltárását célzó nagyszámú kísérlet eredményei között elrejtve az erre utaló nyomok is szép számmal fellelhetõk. Mielõtt azonban ennek ismertetésére rátérnénk, érdemes egy kis kitérõt tennünk, és közelebbrõl megismerkednünk a tanulás és a memória molekuláris folyamataira vonatkozó legújabb elképzelésekkel.
A memóriakutatások egyik alapvetõ kérdése, hogy az emléknyomot a sejtek szintjén mi tárolja, melyek azok a molekulák, amik a rájuk bízott információt hosszú idõn át képesek megõrizni. Különlegesnek kell lenniük, mert a feladatuk egyáltalán nem egyszerû: szervezetünk valamennyi molekulájához hasonlóan elõbb-utóbb mind lecserélõdnek, az általuk tárolt információ azonban néhány napnál-hétnél nem él tovább. A memóriakutatás eredményei arra utalnak, hogy ennek a látszólag megoldhatatlan feladatnak olyan molekuláris kapcsolók képesek eleget tenni, amik valamilyen külsõ jel hatására tulajdonságaikat megváltoztatják, és ezt a megváltozott állapotot azután a kapcsolót alkotó egyedi fehérjék cserélõdése ellenére is fenntartják [2]. Ezt az 1. ábrán bemutatott módon az elõbb már említett autokatalitikus, pozitív visszacsatolást eredményezõ viselkedésük teszi lehetõvé.
Az ábrán olyan molekuláris kapcsolókat mutatunk be, amik létezésére és a memóriafolyamatokban való részvételére kísérleti bizonyítékok vannak. Az elsõ példa egy autofoszforilációra és autoaktivációra képes protein kináz esete. A sejtfolyamatok szabályozásának egyik legáltalánosabb módja a résztvevõ fehérjék és enzimek foszforilációja, vagyis a foszfát észterré alakítása, amit specifikus enzimek, protein kinázok végeznek; a foszforiláció megváltoztatja a fehérjék viselkedését, és így funkcióját. A bemutatott példában olyan kinázenzimrõl van szó (K1), ami a fehérjeszintézis során létrejött, vagyis foszforilálatlan formájában nem mûködõképes, inaktív. Az enzim aktivációjához arra van szükség, hogy egy másik kináz (K2) foszforilálja. Az így aktivált kináz már magát is képes hasonlóan módosítani és aktiválni. Ez a kinázok körében gyakran megfigyelt képesség vagyis az autofoszforiláció biztosítja, hogy a kináz elvileg bármeddig aktív állapotban maradjon, mivel a foszforilálatlan állapotban szintetizálódó új molekulák azonnal foszforilálódnak és aktiválódnak (2. ábra). Bár a kép nem ennyire egyszerû a szervezetben ugyanis a foszfátcsoport eltávolítását katalizáló enzimek is mûködnek, vagyis protein foszfatázok is (P) , sokféle kísérleti bizonyíték utal egy ilyen enzim, a kalcium/kalmodulin függõ protein kináz II (CaMK II) memóriafolyamatokban játszott meghatározó szerepére.
Hasonló elven, bár a molekuláris részleteket tekintve eltérõen mûködik a fehérjeátíródás visszacsatolt szabályozásán alapuló (fehérje expressziós) kapcsoló. Ennek az a legvonzóbb tulajdonsága, hogy a tartós emléknyom kialakulásában bizonyítottan nemcsak a már meglévõ fehérjék módosítása (pl. foszforilációja, lásd elõzõ pont) játszik szerepet, hanem az új fehérjék szintézise és megfelelõ helyre történõ beépülése is. Jól ismert, hogy az új fehérjék a DNS-ben tárolt információ alapján szintetizálódnak, melyeket speciális szabályozó fehérjék, transzkripciós faktorok (TF) irányítanak. Ha a hosszú távú memória kialakulásához szükséges új fehérjék (F) között van olyan, ami a szintézisét elõsegítõ transzkripciós faktor koncentrációjára vagy aktivitására hat, akkor ennek a megemelt szintje a pozitív visszacsatolás miatt nagyon hosszú idõn keresztül fennmaradhat. A visszacsatolás elképzelhetõ úgy is, hogy a fehérje a maga kifejezõdését szabályozó DNS-szakaszra (promóter régióra) hat, de úgy is, hogy közvetve, más fehérjéken keresztül fejti ki ezt a hatást. A transzkripciós kapcsolóval elméletét számos kísérleti megfigyelés bizonyítja, a legtöbb adat a CREB (cyclic AMP response element binding protein) szerepére utal.
A memóriafolyamatokkal összefüggõ sokféle
elképzelés alapvetõen megegyezik abban, hogy az idegrendszerben
az adott pillanatban már a meglévõ fehérjék
módosítása, például foszforilációja
inkább a rövid távú információtárolásban
játszik szerepet; a hosszú távú memória
fõ mechanizmusa a megváltozott fehérjeszintézis.
A rövid távú memóriafolyamatok a hosszú
távú emléknyom kialakulásának alapjai.
Az elõbb vázolt két molekuláris mechanizmus
sem független egymástól: a megváltozott fehérjeszintézist
éppen a rövid távon érvényesülõ
foszforilációs reakciók kapcsolhatják be. E
két folyamat mellett a szakirodalom még számos olyan
molekuláris rendszert is számon tart, amik a pozitív
visszacsatolás elvén alapulnak [2]. A kapcsolók nagyon
sokáig kikapcsolt (naiv) állapotban lehetnek, majd valamilyen
kritikus jel hatására bekapcsolnak, és ezután
tartósan ebben a (tanult) állapotban tartják magukat.
A molekulák megváltozott mûködése által
képviselt információ természetesen az idegsejtek
kommunikációjának tartós megváltozásában
jelentkezik, hiszen abban szinte minden, ezzel foglalkozó kutató
egyetért, hogy az emléknyom nem más, mint az idegsejtek
kapcsolódási pontjai a szinapszisok erõsségének
és mintázatának tartós megváltozása.
A prion mint molekuláris kapcsoló
A prionfehérje ezen folyamatokban játszott esetleges
szerepére az irányította rá a figyelmet, hogy
a prion maga is molekuláris kapcsolóként mûködik
[3]. A prionbetegségek molekuláris mechanizmusának
vizsgálata azt mutatja, hogy ez a fehérje legalább
két szerkezeti állapotban (konformációban)
létezik, a normális sejtes formában (PrPC),
illetve a betegség(ek)ért felelõs scrapie formában
(PRPSC). Ha a prionfehérje egy része valamilyen
okból már átalakult a PrPSC formába,
ez a megváltozott forma a PrPC alak átalakítása
révén bármeddig fennmaradhat: éppen ez áll
a betegség kialakulásának és terjedésének
a hátterében. Ha feltételezzük, hogy a prironfehérjének
a PrPSC formán kívül más, betegséget
nem okozó alternatív formái (PrPA) is vannak,
akkor ezek megjelenése tartós információtárolást
tesz lehetõvé (1. ábra).
Ennek az ún. konformációs kapcsolónak
a lehetséges felépítése lényegében
három, irodalmi adatokkal jól alátámasztott
feltételezésen alapul: 1. a PrPC >PrPA-átalakulás
egy átmeneti alakon (PrP*) keresztül játszódik
le, és egy X jelzésû, még nem azonosított
de bizonyítottan létezõ fehérje segíti
elõ; 2. az átmeneti alak sokkal érzékenyebb
a D-enzim (proteáz) általi fehérjebontásra,
mint a stabil alternatív forma; 3. a PrPA alternatív
forma a PrPC átalakítása révén
éppúgy képes elõidézni saját
képzõdését, mint a prionbetegségekért
felelõs PrPSC alak. A 2. ábrán
bemutatott modellszámítások szerint a fehérje
az autofoszforilációs kapcsolóhoz hasonlóan
mûködik, mivel csak akkor alakul át jelentõs mennyiségben
az alternatív formába, ha a bekapcsoló jel (vagyis
az X-fehérje mennyisége) egy bizonyos küszöbértéket
meghalad; ezt követõen azonban az alternatív forma autokatalikus
tulajdonsága miatt a megváltozott állapot még
az X-fehérje eltûnését követõen
is tartósan fennmarad. A prion szerkezeti sajátságai
tehát elvileg lehetõvé teszik, hogy a memóriafolyamatokban
tartós információhordozóként mûködjön.
De vajon valóban játszik ilyen szerepet? Bár közvetlen
bizonyítékunk nincs rá, sokféle adat utal közvetve
arra, hogy igen.
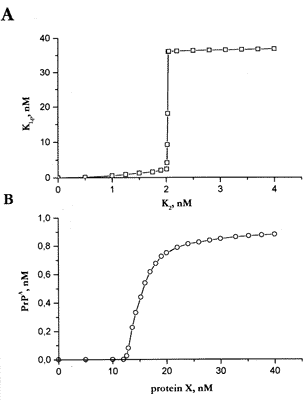
2. ábra. Az autofoszforilációs és konformációs kapcsoló mûködése. Két kiválasztott kapcsoló modellezése (a részleteket lásd a [3] irodalomban) azt mutatja, hogy az ilyen jellegû rendszerek valóban nagyon kis külsô behatásra bekapcsolnak, és azután bekapcsolt állapotban maradnak. A) Autofoszforilácicis kapcsoló. A K2-kináz mennyiségének egy kritikus tartományban történô nagyon kis növekedésére a kapcsoló "átbillen", vagyis a K1-kináz gyakorlatilag teljes mennyisége átalakul az aktivált (foszforilált) formába. B) Konformációs kapcsoló. A prionelven mûködô kapcsolóban a fehérje alakja (konformációja) mindaddig alapállapotban marad, amíg egy másik fehérje (X) mennyisége egy kritikus érték fölé nem emelkedik. Ha ez megtörténik, a fehérje átalakul, és elvileg akármeddig ebben az állapotban maradhat.
A prionfehérje mint memóriamolekula
Az ezzel kapcsolatos elsõ kérdés, amire kitérünk,
hogy a prionbetegségeken kívül ismerünk-e egyáltalán
olyan esetet, ahol a prion konformációs kapcsolóként
mûködik. A válasz igen, bár a példát
a gerincesektõl meglehetõsen távol, az élesztõben
találjuk. Ebben az organizmusban már három olyan örökletes
elváltozást is leírtak, amiket kezdetben genetikai
mutációnak tulajdonítottak, a részletes vizsgálatok
szerint azonban bizonyos fehérjék megváltozott szerkezetének
prionszerû terjedésére vezethetõk vissza. Az
emlõsök prionbetegségével ellentétben
ezeknek a fehérjéknek az önfenntartó, autokatalitikus
módon továbbadódó még az utódsejtekre
is átjutó, vagyis öröklõdõ szerkezetváltozása
nem okoz bajt, sõt bizonyos környezeti feltételek mellett
még elõnyt is jelent a túlélésben. Az
élesztõben tehát megfigyeltek több, prionelven
mûködõ információtároló fehérjekapcsolót
is, ami alátámasztja, hogy a pironfehérjék
a memóriafolyamatokban is képesek lehetnek hasonló
szerepet játszani.
A következõ szempont, amit érdemes közelebbrõl megvizsgálni, hogy az emlõsök prionfehérjéinek létezik-e olyan, a PrPC-tõl eltérõ alakja, ami nem okoz betegséget. Ez idáig senki nem látott ilyen alakot (nem is nagyon keresték), közvetve azonban számos eredmény utal létezésére. A prionbetegségeknek egy érdekes és nehezen értelmezhetõ vonása a különbözõ pirontörzsek léte. Ez annyit jelent, hogy a prionnak ugyanazon állatfajon belül is vannak egymástól jól elkülöníthetõ változatai vagy hagyományos szóhasználattal törzsei , amelyek többszöri átoltás után is stabilan fennmaradnak és megõrzik egyedi jellegzetességeiket. A probléma ott van, hogy mai ismereteink szerint a prionbetegségért a PrP-fehérje nemkívánatos szerkezeti változása a felelõs, vagyis a priontörzsek létére sincs jobb magyarázat, mint feltételezni, hogy a pironfehérjének nem egy, hanem több betegséget okozó alakja is van. Mivel eddig már közel húsz törzset írtak le ami ugyanannyi különbözõ alakot jelent , a prionfehérje szerkezetének rendkívül képlékenynek kell lennie. Az NMR (nuclear magnetic resonance, magmágneses rezonancia) segítségével meghatározott szerkezet valóban azt mutatja, hogy a fehérje rendkívül hajlékony, és így egyáltalán nem elképzelhetetlen, hogy a sokféle betegséget okozó forma mellett olyan alakot is felvehet, amely a normális funkcióhoz szükséges és nem jár együtt patológiás állapot kialakulásával. Ha pedig van ilyen alak, akkor az tartósan fennmaradhat, mivel képes lehet saját maga autokatalitikus sokszorozására.
A prionfehérje elhelyezkedése szintén alátámasztja
a memóriával kapcsolatos elképzelést. A fehérje
csaknem kizárólag a neuronok külsõ felszínén
fordul elõ, és különösen az agykéreg
hippokampusz
nevû területén található nagy mennyiségben.
Talán nem is kell hangsúlyoznunk, hogy a memória az
idegsejtek kapcsolódási erõsségében,
kommunikációjában bekövetkezõ változás.
Ráadásul a hippokampusz az az agyterület, amely nagyon
sok megfigyelés szerint az emléknyom létrejöttében
(tanulás) és kiolvasásában (emlékezés)
is kulcsszerepet játszik. A prionfehérje tehát a memóriafolyamatokban
való részvétel szempontból jobb helyen már
nem is lehetne.
Közvetlen bizonyítékok?
Mindezen megfontolások természetesen csak közvetve
utalnak a prionfehérje memóriafolyamatokban játszott
lehetséges szerepére. Közvetlen bizonyítékot
olyan állatkísérletek adhatnak, amelyekben a fehérjét
nem hordozó állatokat memóriatesztekben hasonlítják
normális társaikhoz. Végeztek is ilyen kísérleteket
egerekkel, amelyek embrióinak genetikai manipulációjával
a fehérje génjét eltávolították
(knock-out egerek). Ezek az egerek teljesen normálisak, semmilyen
feltûnõ fejlõdési rendellenességet nem
mutatnak. Specifikus tesztekben azonban a memóriafolyamatok károsodására
utaló jelek figyelhetõk meg rajtuk. Az egyik tesztben a knock-out
egerek agyából készített hippokampuszszeleteken
az idegsejtek elektromos ingerlésre adott válaszát
vizsgálták. Ezekben az elektrofiziológiai mérésekben
kimutatták, hogy a prionfehérjét nem hordozó
egerek agyában kevésbé lehet a szinapszisok tartós
erõsségnövekedését, vagyis hosszú
távú potencírozást (long-term potentation,
LTP) kiváltani. Ez a megfigyelés a prionfehérjét
egyértelmûen a memóriafolyamatokhoz kapcsolja, mivel
az LTP a memória legtöbbet vizsgált sejtszintû
modellje. Egy másik tesztben közvetlenül az élõ
egerek tanulási képességét mérték.
Az erre a célra leggyakrabban alkalmazott Morris-féle vízi
labirintusban az egeret egy opálos folyadékkal telt kádba
teszik, amelyben a felszín alatt az opálosság miatt
nem látható helyen egy kis dobogó van elrejtve.
A kutatók azt mérik, hogy az egér mennyire jól
emlékszik a pihenõhely helyzetére, vagyis ismételt
próbálkozások során hogyan csökken a kereséssel
töltött idõ. A prionfehérje memóriában
játszott közvetlen szerepét húzza alá,
hogy a knock-out egerek ebben a tesztben valamivel rosszabbul teljesítenek
vad
típusú (vagyis a fehérjét hordozó)
társaiknál. A teljes igazsághoz azonban hozzátartozik,
hogy ezt az eltérést nem minden laboratórium erõsítette
meg, valamint, hogy a knock-out egereknél az adott fehérje
funkciójára nem mindig lehet egyértelmû következtetést
levonni, mivel a fehérje az állat egyedfejlõdése
során végig hiányzik, és így a szervezetnek
módja van a kiesett funkciót másképpen pótolni.
Mindenesetre további vizsgálatok szükségesek
ahhoz, hogy a kérdést egyértelmûen és
megnyugtatóan lehessen lezárni.
Honnan jött és hová tart
a prionfehérje?
A prion szerkezeti sajátossága további érdekes
kérdést is felvet, aminek a megválaszolása
a fehérje esetleges memóriában játszott szerepével
is kapcsolatban állhat. Az ún. oldható, vagyis a sejt
belsejében (a citoplazmában) vagy a sejtek között
(az extracelluláris térben) található
fehérjék túlnyomó többsége jól
meghatározott, kompakt (globuláris), háromdimenziós
szerkezetû, vagyis a prionfehérjétõl eltérõen
nem képes sokféle alakot felvenni. Az evolúció
gyakorlatilag minden esetben eltávolította a fehérjék
funkcióit nem hordozó, a globuláris struktúrától
eltérõ szerkezeti módosulatait. Ennek természetesen
nagyon egyszerû oka van, hiszen az ilyen szerkezetû fehérjék
a legjobb esetben is teljesen feleslegesek, sok esetben azonban mint
például a prionfehérjénél komoly gondokat
is okozhatnak. Ebben az értelemben a prionfehérje léte
rejtély, és nehezen érthetõ, hogy ennél
a fehérjénél az evolúció miért
tett kivételt, miért nem tûnt el a káros szerkezet
az évmilliók során. A válasz nem egyszerû,
de remélhetõleg közelebb visz a fehérje funkciójának
megértéséhez.
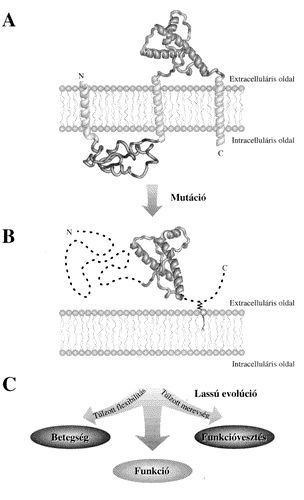
A lehetséges válasz egyik része, hogy a fehérje aminosavsorrendjének (szekvenciájának) változása azért nem zárta ki a bajt okozó szerkezetek lehetõségét, mert ehhez nem állt elég idõ a rendelkezésre. Ez úgy lehetséges, hogy a prion szerkezeti furcsasága evolúciós idõskálán mérve csak nemrég jött létre, és a lassú, mutációs változás még nem volt képes a következmények kiküszöbölésére. Ez alatt nem azt kell értenünk, hogy maga a fejérje csak nemrég jelent meg, sokkal inkább azt, hogy olyan mutációt szenvedett, ami a szerkezet fellazulásával járt. A prionfehérje az idegsejtek külsõ felületén, a sejtmembránhoz horgonyozva helyezkedik el, vagyis helyzete alapján extracelluláris globuláris fehérje. Aminosavsorrendjét vizsgálva azonban nagyon érdekes megfigyelést tehetünk [4]. A fehérjék egy része, amelyek szerkezete nem globuláris, a membránban helyezkedik el úgy, hogy a polipeptidlánc egy, vagy esetleg több helyen is átnyúlik a membrán egyik oldaláról a másikra. Ezek az ún. transzmembrán szakaszok szekvenciális sajátságaik alapján nagy biztonsággal felismerhetõk. A prionfehérjét ilyen szempontból megvizsgálva az derül ki, hogy három olyan részletet is tartalmaz, ami nagy valószínûséggel a membránban helyezkedik vagy helyezkedett el (3. ábra). A fehérje aminosavsorrendje tehát arról árulkodik, hogy nem is olyan régen még membránfehérje volt, és a membránból valamilyen mutáció révén került ki az extracelluláris térbe. Szerkezete az új környezetben természetesen sokkal lazábbá, flexibilisebbé vált, mint azoké a globuláris fehérjéké, amelyek már sok generáció óta itt tartózkodtak.

3. ábra. A prionfehérje membránfehérje? Az emberi prionfehérje 253 aminosavból áll (az ábrán az aminosavak egybetûs kódja látható). A szekvencia szabályszerûségeinek vizsgálata azt mutatja, hogy a fehérje három régiója is (árnyékolt részek) a membránban helyezkedik el.
A sejtes áthelyezõdés modellje tehát magyarázattal szolgál arra, hogy a prionfehérje szerkezete miért olyan flexibilis és hogy ebbõl a szempontból miért üt el annyira a többi globuláris fehérjétõl. Ez azonban valamelyest ellentmondásban van a következõ megfigyeléssel. A fehérje aminosav-szekvenciáját sok fajnál meghatározták, és azt találták, hogy nagyon konzervatív, vagyis sok más fehérjénél kevesebb mutációt, szekvenciális eltérést mutat. A konzervativitás olyan fehérjékre jellemzõ, amik valamilyen alapvetõ funkciót hordoznak, és a szerkezetük ehhez optimalizálódott. Ezeknél csaknem minden aminosavcsere a fehérje mûködõképességének romlásához, esetleg megszûnéséhez vezet, és ezért az ilyen fehérjét hordozó egyedek az evolúciós versenyben hátrányban vannak. A folyamat eredménye, hogy az evolúció csak nagyon kevés változást fogad el, és a szekvencia csak nagyon lassan változik. A prionfehérjénél azonban éppen azt mondtuk, hogy jelenlegi formája csak nemrég keletkezett, a szerkezete flexibilis, és ezért a józan ész logikája szerint gyorsan kellene változnia.
 |
| 4. ábra. A prionfehérje valószínû
története. A prion-
fehérje súlyos betegségeket okozó szerkezeti flexi- bilitását és az ezzel ellentmondásban álló szekven- ciális konzervativizmusát magyarázó evolúciós események. |
Összefoglalás
A prionelv, vagyis a fehérjék autokatalitikus, önfenntartó
szerkezetváltozása sok szempontból is rejtélyes
és nehezen érthetõ jelenség a biológiában,
aminek molekuláris, funkcionális és evolúciós
hátterét csak most kezdjük jobban megérteni.
Sok megfigyelés utal arra, hogy az emlõsök prionfehérjéinek
szerkezeti flexibilitása egy sejtes áthelyezõdést
elõidézõ mutáció következménye.
Bár az így létrejött szerkezeti sokféleség
nagyritkán súlyos betegséget okoz, funkcionális
szempontból kedvezõ, és így az evolúció
során megõrzõdött. A 4.
ábra foglalja össze a prion evolúciójának
három valószínûsíthetõ fázisát.
A): A prionfehérje evolúciós idõskálán
nézve nem régen még membránfehérje volt,
amelynek extracelluláris szerkezeti részlete (doménje)
a sejtfelismerésben, a sejtek közötti kapcsolattartásban
játszott szerepet. B): Valamilyen szekvenciális változás
(mutáció) következtében a membránból
az extracelluláris térbe került. Mivel szerkezete az
evolúció során a membránbeli környezethez
optimalizálódott, az új környezetben rosszul
definiált, vagyis rendkívül flexibilis, képlékeny
lett. Ez az oka annak, hogy esetenként olyan alakot is felvehet,
ami súlyos betegséget okoz. Mivel a fehérjét
egy horgony a membránhoz köti, extracelluláris doménje
az áthelyezõdést követõen is korábbi
helye közelében maradt, és így funkcióját
be tudta tölteni. Valószínûleg ez biztosította
a prionfehérje számára a túlélést,
vagyis hogy a mutációt követõen nem tûnt
el az evolúció süllyesztõjében. C): Bár
egy fehérje flexibilitása bizonyos szempontból nagyon
káros lehet, ebben az esetben a szerkezeti képlékenység
evolúciós elõnyt jelentett, és így megõrzõdött.
Az új funkció feltehetõen profitált a sejtes
kommunikáció már meglévõ, és
a szerkezeti képlékenység újonnan szerzett
képességébõl is.
Az ismertetett megfontolások értelmében
egyáltalán nem elképzelhetetlen, hogy ez az új
funkció a hosszú távú információhordozás,
vagyis a tanulás és a memória folyamataiba való
integrálódást jelentette. A fehérje feltételezhetõen
azóta is a túlzott flexibilitás (betegség)
és a túlzott szerkezeti merevség (funkcióvesztés)
határmezsgyéjén egyensúlyoz, ami szokatlan
szekvenciális konzervatizmusában is megnyilvánul.
IRODALOM
[1]Prusiner, S. B. (1997) Prion diseases and the BSE crisis. Science
278, 24551.
[2]Lisman, J. E. és Fallon, J. R. (1999) What maintains memories?
Science 283, 33940.
[3]Tompa, P. és Friedrich P. (1998) Prion proteins as memory
molecules: a hypothesis. Neuroscience 86, 10371043.
[4]Tompa, P., Tusnády, G. E., Cserzõ, M. és Simon,
I. (2000) Prion protein: evolution caught en route. FEBS Letters, beküldve