Miért piros a paprika?
 A magyar
paprikát a világon mindenütt ismerik. Van csípõs
és van édesnemes, de – ami a fõ – a paprika piros,
mint a rubin. A paprikában van egy kapszaicin nevû anyag,
attól csípõs, és egy kapszorubin nevû,
attól piros. (Mindkét név a paprika latin nevébõl
– Capsicum annuum – származik.) A két vegyület kémiai
képletében a szén- és hidrogénatomokat
nem jelöltük külön, csak a szénvázat
rajzoltuk le. A vonalak minden megtörése, meg a végei
egy-egy szénatomot jelentenek, s hozzá annyi hidrogénatomot,
hogy a szénatomnak mind a négy vegyértéke lekötött
legyen (1. ábra).
A magyar
paprikát a világon mindenütt ismerik. Van csípõs
és van édesnemes, de – ami a fõ – a paprika piros,
mint a rubin. A paprikában van egy kapszaicin nevû anyag,
attól csípõs, és egy kapszorubin nevû,
attól piros. (Mindkét név a paprika latin nevébõl
– Capsicum annuum – származik.) A két vegyület kémiai
képletében a szén- és hidrogénatomokat
nem jelöltük külön, csak a szénvázat
rajzoltuk le. A vonalak minden megtörése, meg a végei
egy-egy szénatomot jelentenek, s hozzá annyi hidrogénatomot,
hogy a szénatomnak mind a négy vegyértéke lekötött
legyen (1. ábra).
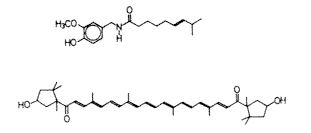
1. ábra. A kapszaicin és a kapszorubin egyszerûsített
képlete
Most már tudunk két nevet, láttunk két képletet, de – hogy miért csípõs és miért piros a paprika – azt ebbõl még nem tudjuk. „Tájékozottabbak” lettünk, de nem értettünk meg semmi újat a természetrõl. Ismerjük be, így van ez tudásunk nagy részével. Sok mindent „megtanulhatunk”, mindent tudomásul vehetünk, de igazi tudást csak a megértés ad! Mit jelent hát megérteni valamit? Megkockáztatjuk ezt a választ: akkor értünk meg egy jelenséget, ha világosan látjuk a kapcsolatát a legáltalánosabb természettörvényekkel. Próbáljunk ilyen igénnyel közeledni a fenti kérdésekhez.
Mindenekelõtt tisztázzuk korlátainkat. A látás is, meg az ízérzés is bonyolult idegrendszeri mûködés. Ennek lényegét kezdjük ismerni, de a részletek még ismeretlenek. A csípõs íz „megértésérõl” egyelõre le kell mondanunk. (Bár gyakorlati szempontból az is nagyon értékes ismeret, hogy tudjuk, a paprikában megtalálható sokféle anyag közül melyik az, amelyik a csípõs ízt kiváltja. De a szerkezet és a hatás közötti összefüggést ezzel még nem értettük meg!)
A színt mindenesetre jobban értjük, mint az ízt. Induljunk ki abból a fizikai-élettani ténybõl, hogy egy testet akkor látunk pirosnak, ha a szemünkbe annak felületérõl csak 750 nm hullámhosszú (vörös) fény jut, vagy ha a test felületérõl visszaverõdõ és onnan a szemünkbe jutó, 400–800 nm hullámhoszszú „fehér” fénykeverékbõl csak az 500 nm hullámhosszú (zöld) fény hiányzik. (Ezért kiegészítõ színek a vörös és a zöld.) A színérzékelés biológiai mechanizmusával most nem foglalkozunk.
A paprika tehát azért piros, mert a felüle visszaverõdõ
és a szemünkbe jutó napfény „hiányos”,
hiányzik belõle a zöld fény. Vagyis a kapszorubin-molekula
szerkezete olyan, hogy az a nap fehér fényébõl
éppen a zöld fényt nyeli el – de miért?... Mert
a benne levõ festékanyag molekulái a fehér
fénybõl kiválogatják a zöld fény
fotonjait, csak az azoknak megfelelõ energiakvantumokat tudják
elnyelni. Az anyagoknak azért van színe, mert bizonyos energiakvantumot
át tudnak venni a fénytõl, mást meg nem. Ha
minden anyag bármilyen energiakvantumot felvehetne, akkor minden
„szín” a fekete és a fehér között változnék.
Szürke lenne a világ! (Vagy az egész fénymennyiséget
elnyelné, akkor fekete volna, vagy csak egy részét
– de válogatás nélkül! – akkor meg szürke;
ha semmit nem nyel el, akkor fehér, ill. átlátszó.)
Milyenek a molekulák?
Az a nagyon fontos tapasztalat, hogy az anyagok színesek, vagyis hogy nem egyformán lépnek kölcsönhatásba a fénnyel, hanem bizonyos színû fényt – bizonyos energiakvantumokat – elnyelnek, másokat nem, a „kézzelfogható” anyag sajátságaira is egészen új fényt vet.
A legtöbb anyag molekulákból, egy molekula atommagokból és elektronrendszerbõl épül fel. A molekula az atommagok és elektronok stabilis, idõben állandó, szervezett rendszere. A fénnyel mégis kölcsönhatásba lép, de nem akárhogyan. Megfelelõ energiaadagokat átvehet a fénytõl, de annál kisebbet vagy nagyobbat nem. Ha többfélét is, nem akármilyent! Ha egy molekula elnyel egy energiaadagot, ezáltal több lesz az energiája. Abból, hogy egy molekula nem vehet fel akármekkora energiaadagot, következik, hogy a molekula energiája nem lehet akármennyi. Pontosabban: a molekula energiája is csak meghatározott adagokban, kvantumokban változhat.
A molekula energiája részeinek kölcsönhatásából származik. A molekulát alkotó atommagok taszítják egymást. Ugyanígy az elektronok is. A magok viszont vonzzák az elektronokat. A vonzások és taszítások egyensúlya alakítja ki a molekula helyzeti energiáját. A magok és elektronok szüntelen mozgást végeznek: ebbõl származik a molekula mozgási energiája. A helyzeti és mozgási energia összege a molekula „összes energiája” [...]
Amikor a molekula elnyel egy fénykvantumot, megváltozik a magok és elektronok kölcsönös elrendezõdése, vagyis a molekula állapota, s ezért megnövekszik a rendszer energiája. (Pl. az elektronok vagy azok egy része távolabb kerül a magoktól.) Abból, hogy akármilyen energiát nem vehet fel a molekula, arra következtethetünk, hogy a magok és elektronok rendszere nem lehet akármilyen állapotban. (Pl. az elektronoknak a magokhoz viszonyított helyzete nem változhat meg akármilyen picit.) Csak hirtelen, ugrásszerûen változhat. Vagy ilyen, vagy olyan. Az állapotváltozáshoz pontosan adott energiára van szükség, ezt nyeli el a fénybõl. Ennél kevesebb energiával nem jut semmire, de többel sem tud mit kezdeni. Vagy megmarad az „alapállapotban”, vagy hirtelen ugrik át egy minõségileg más, ún. „gerjesztett” állapotba. A molekula lehetséges állapotai is „kvantumosak”. Két lehetséges állapot energiája közti különbség egy pontosan meghatározott energiakvantum. Tehát a molekula sokféle állapotban lehet, de nem akármilyenben. Ez a kvantumelmélet lényege.
Ilyesmihez a közönséges méretek birodalmában
nem vagyunk hozzászokva. Megszoktuk, hogy a tárgyak állapota
– ha tetszik, energiája – folytonosan változhat, akármilyen
lehet. Autónk sebességét akármilyen kicsivel
megváltoztatjuk. A csapból kiáramló vízsugarat
is beállíthatjuk tetszésünk szerint. De tudomásul
kell vennünk, hogy az atomok és molekulák világában
nincs folytonos átmenet egyik állapotból a másikba
[...]
Elektron a dobozban
Képzeljünk el egy elektront, amely be van zárva egy „dobozba”. A „doboz” jelenti, hogy az elektron a térnek csak egy meghatározott részén lehet. Azon belül semmiféle erõ nem hat rá, de azt a térrészt el nem hagyhatja. Legyen a „doboz” ráadásul „egydimenziós”, ami mindössze azt jelenti, hogy az elektronnak egy vonalszakasz áll rendelkezésére. (Ilyesmi – szigorúan, geometriai értelemben véve – nem valósulhat meg, de így egyszerûen kezelhetõ a probléma.) Az L hosszúságú vonalszakaszon belül tartózkodhat az elektron, de azt el nem hagyhatja. Az elektronra az „egydimenziós dobozon” belül semmiféle vonzó vagy taszító erõ nem hat, mégis az elektron a dobozban is „sokféle, de nem akármilyen” állapotot vehet fel. Helyzeti energiája nem változhat, mert nincs neki; a doboz minden erõhatástól mentes. Változhat viszont a mozgási energiája. A dobozba zárt elektron lehetséges állapotait tehát mozgási energiájának változó értékei jellemzik; ez sokféle lehet, de nem akármekkora [...]
Vizsgálgassuk tovább eléggé „absztrakt”,
de legalább egyszerû modellünket: az egydimenziós
kalitkába zárt elektront. Az anyag háromdimenziós,
legalábbis ez a kép felel meg mindennapi szemléletünknek.
Ha a valósághoz közelebb álló modellt
akarunk készíteni, zárjuk legalább háromdimenziós
dobozba az elektront. Az elõbbi gondolatmenet ahhoz az eredményhez
vezetne, hogy az elektron lehetséges állapotait most háromdimenziós
állóhullámokkal modellezhetjük, s a lehetséges
energiaállapotokat most három-három egész
számmal jellemezhetjük. Itt a három kvantumszám!
Hiszen ezt tanulja minden elsõs gimnazista a kémiában:
„Az atomban kötött elektron állapotát három
kvantumszámmal jellemezhetjük”. Az atomban kötött
elektronnak a mag vonzása a „háromdimenziós kalitkája”.
A mag vonzása nem engedi, hogy eltávolodjék, az tartja
a „dobozban”, vagyis az atomon belül. Az összefüggések
a hidrogénatom esetében formailag kicsit módosulnak,
mert a mag centrális vonzása gömb alakú kalitkát
létesít az elektronnak, de a lényeg mégis ugyanaz:
a lehetséges elektronállapotokat – kvantumállapotokat
– háromdimenziós állóhullámok írják
le. A sokféle, de nem akármilyen állapotnak ezek a
modelljei, a mintái.
Konjugált poliének
Térjünk vissza végre a paprikához. A színért felelõs kapszorubin-molekula nagyon bonyolultnak látszik, bizonyos tekintetben mégis egyszerû: van benne „egydimenziós doboz” – egydimenziós „kifutópálya” – az elektron számára. (Ezt hívjuk komolyabb szóval molekulapályának.)
Nézzük meg jól az 1. ábrát, emeljük ki a molekula középsõ részletét és vizsgáljuk meg alaposabban. A váltakozó egyes és kettõs kötéseket tartalmazó szénláncot nevezzük konjugált láncnak. A kapszorubin-molekula közepén tehát egy meglehetõsen hosszú konjugált láncrészlet található. Törõdjünk most csak ezzel. A két gyûrû a molekula két szélén a szín szempontjából érdektelen. A sok konjugált kettõs kötést tartalmazó vegyületeket konjugált poliéneknek nevezzük.
Írjuk le részletesebben a fenti vonalas képletet – legalábbis annak egy részletét –, de hagyjuk ki belõle a kettõs kötéseket (2. ábra). Mit szimbolizál ez a képlet? A H betûk egy-egy meztelen protont (a hidrogénatom esetében az atomtörzs az atommaggal azonos), a C betûk meg a 6 pozitív töltésû magot, beburkolva két elektronnal, amelyeket olyan szûk kalitkába zár a mag erõs vonzása, hogy a kémia számára hozzáférhetetlenek. A kémikus ezért a C betûvel ezt a kifelé már csak 4 pozitív töltést hordozó mag–elektron együttest, a szénatomtörzset jelöli.
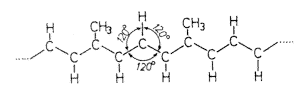
2. ábra. A kettõs kötések elhagyásával
felírt moelkula szénláncának részlete;
valamennyi atomtörzs egy közös síkban van
A kapszorubin hosszas kutatómunkával felderített molekulaszerkezete azt mutatja, hogy a molekula középsõ láncrészletében az atomtörzsek úgy rendezõdnek el, hogy egy-egy szénatomtörzset nem a maximális négy, hanem csak három másik atomtörzs (szénatomtörzs vagy proton) vesz körül. Az elrendezõdés szép szimmetrikus: a központi szénatomtörzset az egyenlõ oldalú háromszög szimmetriája szerint veszi körül a vele egy síkban levõ három másik atomtörzs. A „cikcakkos” molekularészlet valamennyi atomtörzse egy közös síkban van.
A kötõvonalak – mint tudjuk – elektronpárokat jelentenek, amelyek nem egy-egy, hanem két-két szomszédos atomtörzs „bûvkörében” vannak. Ezek a kötõ elektronpárok (s-állapotú elektronpároknak nevezzük õket) jól be vannak zárva a két szomszédos atomtörzs erõs vonzásának szûk kalitkájába. Szinte oda vannak cövekelve az erõtérbe. Kimozdítani õket onnan nagyon nehéz. Az elektronpárok taszítják egymást, ezért rendezõdnek el úgy, hogy az egy atomtörzs körül levõk a sík három irányába (kereken 120o-os szögekbe) taszítják szét egymást. Így juthat a túlságosan összezsúfolt elektrontársadalom viszonylag a legtöbb helyhez.
Amit eddig lerajzoltunk, vagyis az atomtörzsek és az ún. s-elektronpárok rendszerét nevezzük a polién-molekula s-vázának. Rajzoljuk le ezt a s-vázat egyszerûbben. Az egész olyan, mint egy laposan szétterülõ, tömör elektronfelhõ, amelybõl azonban még minden széntörzs körül kisüt, kisugárzik a széntörzsek még kompenzálatlan „negyedik” pozitív töltése (3. ábra).
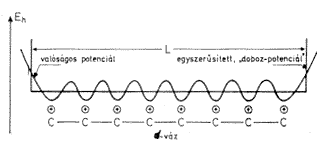
3. ábra. Az elektron helyzeti energiáka a s-váz
mentén
Ha létezne egy ilyen s-váz önmagában, s ahhoz messzirõl egy „kóbor” elektron közeledne, az valami olyasfélét „látna” benne, mint a korábban emlegetett „egydimenziós doboz”. Azt „érezné”, hogy valami hosszú, elnyúlt pozitív erõtér vonzza. A síkban tömörülõ sok elektron valahogy egybeolvasztja az elektronnal még kielégítetlen atomtörzsek külön-külön vonzását, s a s-váz úgy hat, mint egy hosszúkás, egy irányban elnyúlt „egydimenziós” pozitív erõtér.
Mi történik hát a „kóbor” elektronnal? A magok közvetlen közelébe nem kerülhet, mert a magok közös síkja úgy meg van tömve a s-elektronokkal, hogy ott már minden hely foglalt. A még nem teljesen kielégített magok vonzása csak a s-elektronok árnyékoló „ernyõjén” át, nagyjából egybemosódva érvényesül. Az elektron úgy tehet eleget a magok vonzásának és a többi elektron taszításának, hogy olyan helyet tölt be, ahol más elektron nincs, de a magvonzás még érezhetõ; ezért a s-váz fölött és alatt helyezkedik el, a széntörzsek láncának vonalában. Ezt az elektronállapotot, amikor az elektron éppen a magok közvetlen közelébõl, a magok síkjából van kitiltva (a többi elektron által), p-állapotnak nevezzük. A hosszú, konjugált szénlánc s-vázára telepedõ elektron nemcsak egy vagy két szomszédos atomtörzs erõterére zsugorodik össze, hanem szétterül az egész konjugált lánc mentén, ezért az ilyen állapot „delokalizált” p-állapot.
Lerajzolhatjuk, hogyan változik az elektron helyzeti energiája a konjugált szénlánc mentén. A széntörzsek közvetlen közelében valamivel nagyobb a vonzás, mint két széntörzs között, ott tehát valamivel mélyebb a helyzeti energia, mint emitt. Az elektron helyzeti energiáját tehát hullámvonal írja le.
Említettük, hogy a s-elektronrendszer nagyjából kiegyenlíti a magok vonzását, ezért nem követünk el nagy hibát, ha a helyzeti energia hullámvonalát „kiegyenesítjük”. A konjugált lánc két végén meg úgy rajzoljuk, mintha meredeken menne fölfelé. Ez azt jelenti, hogy a s-váz mentén az elektron helyzeti energiája végig egyforma, de onnan az elektron nem szabadulhat ki, mert „meredek fal” állja útját. Valószínû sokan rájöttek már, hogy ez a sima aljú, meredek falú „potenciáltepsi” valójában ugyanaz, mint az „egydimenziós doboz”. (Az egy dimenziót persze nem szabad teljesen szó szerint érteni, hiszen az elektron fölül is van, meg alul is, meg szélességben is van kiterjedése, de a hosszan elnyúlt s-váz annyira aránytalanul kígyószerû, hogy az egydimenziós doboz egész jó modelljének ígérkezik.) Alkalmazzuk hát a húrmodellt erre az esetre. Miben különbözhetnek egymástól a delokalizált p-állapotok? Csak a mozgási energiában, mert a helyzeti energiát a s-váz fölött és alatt végig azonosnak és állandónak tekintjük. A „sokféle, de nem akármilyen” elektronállapotot jellemzõ kvantumszámok tehát csak a mozgási energia értékeire vonatkoznak, ugyanúgy, mint a dobozmodellben [...]
Most már majdnem célnál vagyunk, de még valami fontos hiányzik. Eddig egyetlen „kóbor” elektronról beszéltünk, amely valahogyan odatévedt a pozitív töltésû s-váz erõterébe, s éppen most azt számítottuk ki, milyen lehetséges állapotok állnak rendelkezésére. A „kényelmes” elektron természetesen a lehetõ legkisebb energiájú, legmélyebb p-állapotot foglalja el. A valóságosan létezõ konjugált polién-molekulában – pl. a paprika színes kapszorubinjának molekulájában – azonban nem egy p-elektron van, hanem annyi, hogy a s-váz minden töltése semlegesítve legyen, vagyis pontosan annyi, ahány háromligandumos szénatom sorakozik a s-váz konjugált láncában. Hová kerülnek ezek az elektronok? Természetesen a rendelkezésre álló p-állapotokat töltik meg [...]
Egyszerûen annyit kellett feltételeznünk, hogy a mikrorendszerek kvantumosságát, vagyis azt a sajátságát, hogy sokféle, de nem akármilyen állapotban lehetnek, állóhullámrendszerekkel modellezhetjük. Valójában ezt akartuk bemutatni, a paprika piros színe csak ürügy volt. Azért választottuk éppen ezt a példát, mert a konjugált poliének delokalizált p-elektronállapotai a legegyszerûbb állóhullámrendszerrel, az „egydimenziós” húr állóhullámaival modellezhetõk. A valóság természetesen sokkal bonyolultabb, mint a modell. De a modell mégis valami lényegeset ragad meg a valóságból.
A modell finomítható, akkor a számított adatok pontosabban egyeznek a kísérletileg meghatározottakkal, de természetesen a számítási módszerek is egyre bonyolultabbakká válnak [...]
A kísérleti tapasztalat azt mutatja, hogy azok az anyagok színesek, amelyekben kiterjedt, delokalizált p-állapotok vannak. Ha az elektronnak kellõen nagy térrész áll rendelkezésére, akkor energiáját (elsõsorban a mozgásit) kis adagokban változtathatja, tehát már a látható fény viszonylag kis energiájú fotonjait is elnyelheti; ezért színes... Az ún. „telített” szénvegyületek molekuláiban, amelyekben csak s-állapotú elektronok vannak, minden elektron nagyon szûk helyre – két-két mag környezetére – van beszorítva. Ezek „gerjesztéséhez” csak nagy energiájú fotonokkal rendelkezõ, kis hullámhosszú ultraibolya fény alkalmas. A „látható” fénybõl ezek semmit nem nyelnek el, az tehát változatlanul halad át rajtuk vagy verõdik vissza róluk. Ezért az ilyen anyagok színtelenek. Színessé csak akkor válik egy anyag, ha molekulájában az elektronnak kellõen hosszú „kifutópálya” áll rendelkezésére. Ilyen körülmények között kis adagokban változtathatja energiáját. Ilyen elnyúlt, kiterjedt elektronállapotok csak a konjugált rendszerek delokalizált p-állapotaiban valósulnak meg. Ha a polién elég hosszú, vagyis az L elég nagy, akkor az energiaadag a látható fény valamelyik komponensének energiájára csökken. Ezt elnyeli a molekula, s a „hiányos” maradék fény színesnek látszik.
Végre megadhatjuk a szakszerû választ a címben
feltett kérdésre. A paprika azért piros, mert a kapszorubin-molekulában
az elektronok egy része hosszú „kifutópályán”,
sok szénatomtörzsre kiterjedõ, delokalizált p-állapotban
van. Az ilyen elektron már a látható fény kis
energiájú fotonjának elnyelésével is
megváltoztathatja állapotát, átugorhat egy
másik delokalizált p-állapotba. A paprika színességét
az anyag állóhullámmodellje alapján értettük
meg.
| Természet Világa, | 132. évfolyam, 5. szám, 2001. május
https://www.chemonet.hu/TermVil/ https://www.kfki.hu/chemonet/TermVil/ |
Vissza a tartalomjegyzékhez