„Nem szállitottad földre Dianát,
Nem verted fák közül ki a driádot,
Hogy költözzön egy jobb csillagra át?”
Edgar Allan Poe „Szonett a Tudományhoz” című versében teljes joggal kéri számon a gyorsuló iramban fejlődő tudományon, hogy kifordítja sarkaiból az addig ismert világot és egyre ingoványosabb területekre merészkedik, ahonnan már nincs visszaút. Pedig csak 1829-et írunk, amikor az aggódó értelmiséget még további 30 év békés tudatlansága választja el Darwin korszakalkotó művének, A fajok eredetének megjelenésétől, amely végérvényesen kijelöli az ember helyét a létért való küzdelem viharaiban. Poe még nem sejti, hogy a XX. század közepére az ipari fejlődés és a tudomány frigyéből egy ellentmondásos, kibogozhatatlanul bonyolult világ bontakozik ki. Olyan világ, amelyben egyszerre születnek totalitárius rendszerek a humanista értékrend lebontására, megmutatva, hogy többé már nem „mindennek mértéke az ember”, miközben a sokasodó tudományos felfedezések életre hívják az antibiotikumok és a védőoltások világát, megágyazva az egészségbiztosítás széleskörű elterjedésének, valamint a molekuláris biológia, az internet és a globális kereskedelem korszakának.
Poe Amerikájában a tudomány már elég erős ahhoz, hogy elkezdje lebontani a régi világ hiedelmeit, de még nincsenek érdemi eszközei, hogy felvegye a harcot a betegségekkel szemben. A magas újszülött-kisgyermek mortalitás, illetve a fertőző betegségek elleni hatékony védekezés hiánya miatt a születéskor várható élettartam 40 év körül volt az 1800-as évek derekán, miközben az 5 éves kort elérők átlagosan 50-60 évnyi életre számíthattak. Ez ma a fejlett társadalmak esetén körülbelül 80 év. Még szembeötlőbb az elmúlt száz évben lezajlott változás, ha megvizsgáljuk az elhalálozás főbb okait a XIX. században, és összevetjük ezeket a közelmúlt adataival. A különféle fertőző betegségek, mint az influenza, a tuberkulózis, a paraziták okozta, vagy emésztőszervi elváltozások dominanciája helyett, napjainkra a szív-érrendszeri és daganatos betegségek váltak vezető halálokká. A legfejletlenebb közösségekben, ahol az egészségügyi ellátás nem hatékony, ma is nagy az újszülött halandóság és elterjedtek a fertőző kórképek, miközben a fejlődő társadalmakban megfigyelhető ezek visszaszorulása más betegségcsoportok, mint a cukorbetegség vagy az elhízás térhódítása mellett. Különösen aggasztó, hogy a fejlett társadalmakban a krónikus betegségek gyakorisága szinte minden korcsoportban emelkedik. Tehát nem csupán arról van szó, hogy ma tovább élünk, mint Poe korának polgárai, és ezért elegendő idő jut a lassan, de biztosan ölő elváltozások kialakulására, bár a megnövekedett életkor kétségkívül jelentős tényező számos civilizációs betegség elterjedésében világszerte. Ezzel párhuzamosan ugyanakkor az életmódunk is gyökeresen megváltozott. Az átlagos, többségében földeken vagy gyárakban dolgozó, alultáplált amerikai vagy európai „polgár” nehezen ismerne rá az olcsó gyorséttermi vagy fagyasztott kaján élő, túlsúlyos leszármazottaira, akik életük java részét egy irodai szék ölelésében töltik, és akiket az egészségügyi ellátórendszerek a magzati kortól hatékonyan védenek a fertőző ágensek és az általuk okozott tünetek többsége ellen.
Mivel a fertőző betegségek elleni védekezés hatékonyabbá vált, miközben az orvostudomány komoly sikereket ért el a szavatosságukat vesztett emberi alkatrészek szervizelésének, illetve cseréjének terén is (gondoljunk csak a mesterséges szívbillentyűkre, pacemakerre, szervátültetésre, vérhígítókra vagy az inzulinra), számos tényező, ami általában elhalálozásunkat szokta okozni, megelőzhetővé vagy késleltethetővé vált. Ez önmagában hatalmas siker, hiszen tudományos áttörések sorozata kellett ahhoz a biológia, a fizika, és a kémia műhelyeiben, hogy a ma már rutinszerűen alkalmazott képalkotó vagy biokémiai vizsgálatokkal időben felismerhetők, majd gyógyíthatók legyenek olyan betegségek, amelyek természetéről Poe korában szinte semmi nem volt tudható. Felmerült ugyanakkor számos dilemma, amelyek többsége máig megoldatlan. Az egyik a ”compression of morbidity” sokat vitatott problémája, amelyet eredetileg James Fries, a Stanford egyetem professzora fogalmazott meg. Ideális esetben, az orvostudomány fejlődésével ki kellene, hogy tolódjon az egészségesen töltött életidő, és csökkennie kellene a krónikus betegségben vagy fogyatékosságtól terhelten töltött évek számának, mielőtt a halál bekövetkezik. Ezzel párhuzamosan újra és újra felvetődik a kérdés, hogy létezik-e egyáltalán egészséges öregedés, és ha igen, milyen jellemzői vannak. Meddig tartható fenn megfelelő életminőség adott kórképek esetén, és milyen egy „egészséges” idős ember ideális állapota? Sok esetben ugyanis a krónikus kondíciók okai és hatásai nem szüntethetők meg, csupán időben kitolhatóvá – és talán elviselhetővé – válik egy betegség; azaz az élet hosszabbodásával a betegségben töltött életévek növekednek, amely természetszerűen a kezelési költségek növekedését is maga után vonja. Ez komoly dilemmát okoz nem csak az ellátórendszereknek, de a betegek és a személyre szabott orvoslás megvalósításán fáradozók számára sem világos, milyen kórfolyamatokkal szemben lehet eredményesen felvenni a harcot megelőzés vagy célzott terápiák segítségével, és milyen korral, genetikai háttérrel vagy más tényezőkkel kapcsolatos biológiai elváltozások azok, amelyek nem, vagy nem hatékonyan tarthatók kordában hosszúidegrendszer működése és betegségei. Mint a biológia terén mindent, az idegrendszeri elváltozások okait is célszerű az evolúció szemüvegén át nézni, még akkor is, ha tudásunkból jelenleg számos alapvető részlet hiányzik. Ahogy a rossz nyelvek éles, de találó meglátása szerint az ember a válóokkal nősül, a központi idegrendszer is számtalan fejlődési állapoton ment át az évmilliók során, mielőtt mai formáját elérte. A természetes szelekció eközben dominánsan nem az idős, szaporodni csak korlátozottan képes egyedek immun- vagy kognitív funkcióinak megtartására szorítkozott, és különösen készületlen volt arra, hogy a táplálék megszerzéséért és a kalóriák hatékony felhasználásáért vívott küzdelmet ez a nagyra nőtt majom egykor majd röpke száz év leforgása alatt lecseréli mozgásszegény életmódra és csokoládéfogyasztásra.
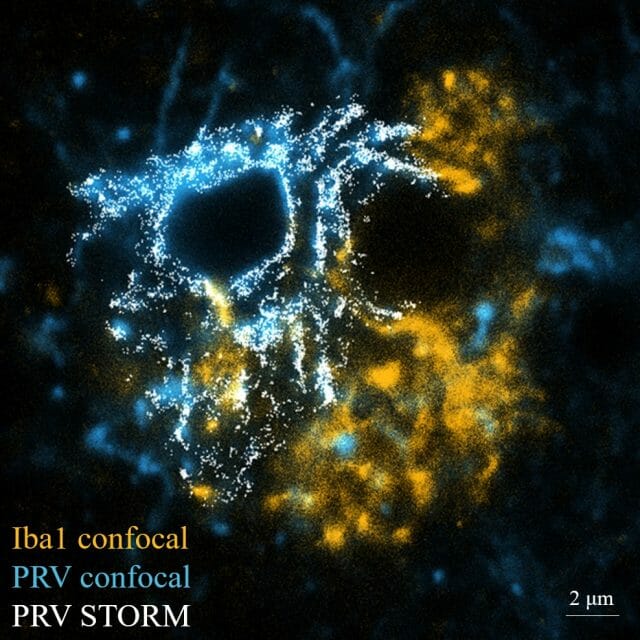
Ma már sejthető, hogy az idegrendszeri betegségek gyakoriságának növekedésében komoly szerepet játszik az immun- és az idegrendszer közti interakciók egyensúlyának felborulása. Természetes környezetben a fertőzések jelentik a legnagyobb kihívást, ezért elengedhetetlen az immunrendszer gyors és hatékony reakciója minden sérülésre vagy bármely patogén jelenlétére válaszul. Az agyat ugyanakkor több ok miatt is el kell szigetelni a keringéstől és a perifériás immunfolyamatok elől. Egyrészt, a komplex idegrendszeri működés nagyon sok energiát és folyamatos oxigénellátást igényel. Bár az agy a testtömeg mindössze két százalékát teszi ki, a teljes keringés 20-25 százalékát is felhasználja. Mivel az idegsejtek rendkívül érzékenyek az oxigénhiányra, biztosítani kell a keringés tág határokon belüli állandóságát (autoreguláció). Másrészt, fenn kell tartani a megfelelő ionegyensúlyt és molekuláris kompozíciót, amelyek különböznek a vér összetételétől. Harmadrészt, mivel az idegsejtek sérülékenyek és nehezen pótolhatók, a hatékony, de potenciálisan nagy károsodást okozó immunfolyamatok veszélyesek lehetnek. Gondoljunk csak arra, hogy egy ujjunkba fúródott tüske okozta gyulladás miatt akár napokig képtelenek vagyunk bármit is megfogni, miközben a gyulladt területtel azonos méretű agyterület kiesése a motoros kéregben kezünk végleges bénulását okozhatja. Mivel az idegsejtek mikrokörnyezetük izolációjára önmagukban képtelenek, a központi idegrendszer fejlődése során specializált sejttípusok alakultak ki. Az agyi kapillárisok falát az agyszövettől elválasztó vér-agy gát szorosan kapcsolódó endothelium sejtekből áll, amelyeket asztroglia sejtek végtalpai borítanak, szabályozva az agyi erek falán történő víz, ionok, makromolekulák és immunsejtek forgalmát. A közelmúlt felfedezései azt is megmutatták, hogy az agykamrák plexusaiban termelődő liquor, amely az agyműködéshez elengedhetetlen molekulák forgalmát biztosítja, az asztroglia-végtalpak és az erek közti térben is folyamatos áramlást mutat, hasonlóan a perifériás szervekben a sejtek közti térben felgyűlő folyadékot és immunsejteket tartalmazó nyirokhoz (ez alapján nevezték el glimfatikus, azaz gliális-limfatikus rendszernek). Külön barrier struktúrák alakultak ki az agyban a liquor és a vér elkülönítésére is (vér-liquor gát), amelyet a liquort termelő kamrai choroid plexus specializált epithelium sejtjei biztosítanak. Az agyszövetet a keringéstől elválasztó barrier struktúrák nem csupán a makromolekulák, de az immunsejtek forgalmát is nagyban korlátozzák, amelyek sokkal szabadabban őrjáratoznak a perifériás szervek szöveteiben, különösen azokon a határfelületeken, ahol állandóan nagy a fertőzés veszélye (szájüreg, légutak, húgyutak nyálkahártyája, tüdő, belek, stb). Az agyi nyirokerek jelenlétét csak a közelmúltban sikerült kimutatni, ahol normális esetben a perifériákhoz képest jóval kevesebb immunsejtet találunk. Az agy fejlődése során ugyanakkor a keringés felől bejutó sejtek az ereken felül az agyhártyákat, és az agykamrák falának képleteit is kolonizálják, amely területek sérülés vagy fertőzés esetén a felnőtt agyban is a fehérvérsejtek – sokszor nagy károsodást okozó – beáramlásának fókuszává válnak.
Mivel az agyban is szükséges a sérült vagy elhalt sejtek hatékony eltakarítása, illetve a patogének elleni védelem, az agyi immunfolyamatokat (és még sok minden mást) egy, rendkívül sokoldalú sejttípus, a mikroglia szabályozza. A mikroglia az egyedfejlődés során korán, az első trimeszterben vándorol be a fejlődő agyba a szikzacskóból, amely az embrión kívül található. Ezt követően az osztódó mikroglia sejtek élethosszon át önfenntartó populációt képeznek a központi idegrendszerben és mozgékony nyúlványaikkal folyamatosan monitorozzák az agyszövet állapotát. Érzékenyek a legapróbb változásokra is, beleértve az idegsejtek aktivitás változását, sérülését, a vér-agy gát funkciójának megváltozását vagy mikrokörnyezetük ionegyensúlyának, oxigéntartalmának fluktuációját. Szöveti sérülés esetén a mikroglia aktivitása megváltozik, percek (vagy órák) alatt izolálja a sérült területet, bekebelezi az elhalt, vagy keringés felől érkező sejteket, és gyulladásos faktorokat termel. A közelmúlt kutatásai megmutatták, hogy a mikroglia egyszeri, gyulladásos stimulus hatására történő aktivációja végérvényesen megváltoztatja génjeik kifejeződését, és ezzel a gyulladásos faktorok termelődését is. Érdemes elgondolkozni azon, hogy minden anyai hatás, amely a fejlődő embriót éri, megváltoztathatja az agyat kolonizáló mikroglia sejteket, amelynek számos fejlődéstani következménye lehet. A közelmúlt klinikai és kísérletes adatai alapján valószínűleg nem véletlen, hogy számos fejlődési rendellenesség, illetve gyermekkori viselkedészavar (ilyenek például az autizmus egyes formái vagy az ADHD) hátterében kimutatható a magzati korban vagy születést követően fellépő fertőzés, gyulladás, vagy oxigénhiány, amelyek mindegyike együtt jár a mikroglia sejtek aktiválódásával és gyulladásos faktorok termelődésével az agyban is.
Poe korának természettudósai valószínűleg hitetlenkedve fogadták volna a tényt, hogy termékeny gondolataik nem mások, mint hálózatokba rendeződött idegsejtjeik elektromos aktivitásának bonyolult jelhalmazai. Még a modern kor emberének is furcsa ezt elfogadni, különösen, ha azt is hozzátesszük, hogy a szervezetben zajló gyulladásos folyamatok a látszólag jól elszigetelt agyban működő idegsejtek tevékenységét is nagymértékben befolyásolják. Pedig hasonlóan a régmúlt korok polgáraihoz, mi is mindannyian éreztük már a saját bőrünkön, hogy milyen furcsa állapotokat hozhatnak létre a testünkben általában észrevétlenül működő szuperrendszerek kölcsönhatásai. Az elsőként tüdőt érintő, influenza vírus vagy Streptococcus baktérium által okozott fertőzés például a betegség előrehaladtával számos szervünkben (lép, máj, vese, csontvelő, stb.) okoz változást, azaz ún. szisztémás hatásai vannak. A patogéneket a tüdőben felismerő és azt elpusztítani készülő immunsejtek ugyanis aktiválódnak, gyulladásos faktorokat termelnek, amelyek a primer szövetek bizonyos mértékű érintettsége esetén további sejttípusokat mobilizálnak a nyirokcsomókból, a csontvelőből vagy a lépből, miközben a májban termelődő ún. akut fázis fehérjék, citokinek és kemotaktikus faktorok termelődése mellett koordinálják a szervezet immunfolyamatait, illetve a keringés és szöveti anyagcsere változásait annak érdekében, hogy a kórokozók elleni védekezés minél hatékonyabb legyen. A keringésbe jutó gyulladásos faktorok a szervezet számos pontján okoznak változásokat, amelyek alól nem kivétel az agy sem. Ma már tudjuk, hogy az influenzát kísérő láz, levertség, zavaros álmaink és kusza gondolataink javarészt annak eredményei, hogy gyulladásos fehérjék, mint például az interleukin-1 (IL-1), vagy a tumor nekrózis faktor (TNF), ingerlik az agyi hipothalamusz régió megfelelő idegsejtcsoportjait – zömmel olyan kapukon át, ahol a vér-agy gát nem teljesen zárt – áthangolva ezzel a hormonális rendszert, és az agyi ideghálózatok működését. Ez részben a hipotalamusz-hipofízis rendszer és a vegetatív idegrendszer közvetítésével, részben a gyulladásos faktorok direkt hatásainak eredményeként aztán komoly változásokat okoz a szisztémás keringésben és számos perifériás szervben, amelynek eredménye többek között a hőháztartás és a nyálkahártyák állapotának megváltozása. A szerencsétlen polgár tehát étvágytalan, tüsszög, reszket, tucatszámra fújja a papírzsebkendőt, és percenként elátkozza a piros ruhás nénit, aki rátüsszentett a buszon. Normális esetben a fertőzés végül elmúlik, az étvágy és az életvágy visszatér, aminek eredményeként mindjárt más színben látjuk a világot.
Mi történne, ha a fertőzés okozta, vagy más folyamatok révén kialakuló gyulladás sohasem múlna el? Mindannyian jól ismerjük, hogy mennyi kellemetlenséggel tud járni egy begyulladt ízület, egy nehezen gyógyuló seb, vagy egy rossz fog. Mit éreznénk, ha az agyban termelődő, vagy a keringés felől az agyat elérő gyulladásos faktorok heteken, hónapokon, éveken, vagy akár évtizedeken keresztül uralkodnának a hangulatunkon, az étvágyunkon vagy a gondolatainkon? Meglepő módon, egyre több kutatási eredmény mutatja, hogy számos krónikus betegség esetén pontosan ez a helyzet. Jó példa erre a depresszió. Hamlet ismeri ezt az állapotot:
„Én egy idő óta (bár nem tudom, miért) elvesztettem minden kedvemet, s felhagytam minden szokott gyakorlatimmal; és, igazán, oly nehéz hangulatba estem, hogy ez a gyönyörű alkotmány, a föld, nekem, csak egy kopár hegyfok; ez a dicső mennyezet, a lég, ez a felettem függő kiterjedt erősség, ez arany tüzekkel kirakott felséges boltozat, no, lássátok, mindez előttem nem egyéb, mint undok és dögletes párák összeverődése.”
Shakespeare sebészi pontossággal írja le, hogyan változik meg a világ egy depressziós ember szemében. Hamlet történetét ismerve azt is megérthetjük, hogy tartós rossz kedve indokolt. Ugyanakkor valószínűleg csekély irodalmi sikerre számíthatna az, aki állapotát nem anyjával, apjával vagy Opheliával való viszonyából, hanem az IL-1 agyi hatásainak elemzésén át próbálná meg levezetni. A helyzet ugyanakkor az, hogy a gyulladásos faktorok tartósan emelkedett szintje, vagy a termelődésüket szabályozó génváltozatok nagy beteganyagon elvégzett vizsgálatok szerint erős korrelációt mutatnak számos pszichiátriai betegséggel, mentális zavarokkal, vagy hangulatváltozásokkal, mint a skizofrénia vagy a depresszió. Állatkísérletek tucatjai igazolták, hogy az IL-1 vagy a TNF termelődése önmagában képes a betegségérzet és ezzel összefüggő viselkedés-együttes (sickness behavior) előidézésére, hatásaiknak gátlása ugyanakkor eredményesen csökkenti a depresszív tüneteket különféle modellekben. Több releváns humán vizsgálat is hasonló eredményt hozott önkéntesek bevonásával, akikben szisztémás gyulladást idéztek elő kis dózisú bakteriális endotoxin, vagy más immunstimulánsok segítségével. Ma már tudjuk azt is, hogy számos gyulladásos anyag, amely az immunrendszer és az idegrendszer közti kommunikációt irányítja (köztük az IL-1), kifejezetten káros az idegsejtekre, ha nagyobb mennyiségben termelődik az agyban, vagy jut be az agyszövetbe a keringés felől.
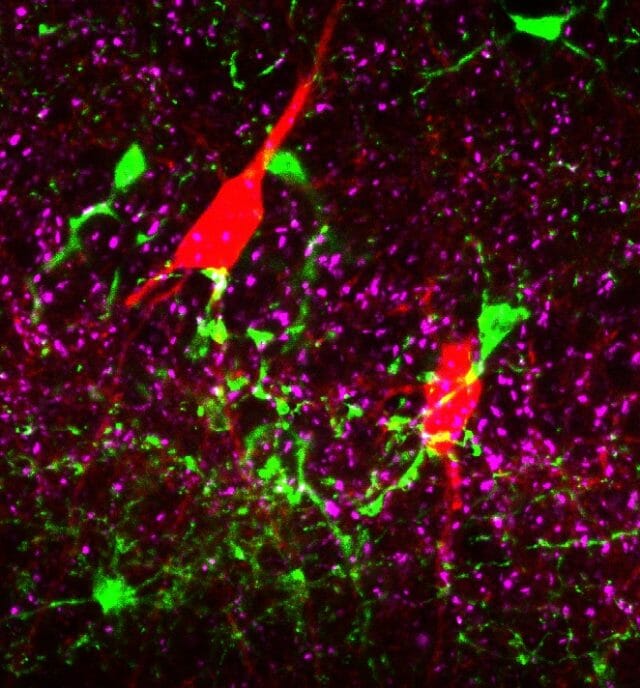
Itt érdemes visszakanyarodni a krónikus betegségek és az idegrendszer betegségeinek kapcsolatához, amely a modern kor embere számára számos, egyelőre megoldatlan problémát állít. A közelmúlt kutatásai megmutatták, hogy az olyan népbetegségek, mint a diabétesz, az érelmeszesedés, a magas vérnyomás vagy az elhízás egyben krónikus gyulladásos állapotot is előidéznek. Ez egyrészt a gyulladásos faktorok tartósan megemelkedett szintjét jelenti a keringésben, számos perifériás szervben és az agyban is. A perifériás szervek és az agy ereinek állapota megváltozik: például az endothelium adhéziós molekuláinak fokozott termelése miatt az erek az immunsejtek számára „ragadósabbá” válnak, hasonlóan ahhoz, amikor ezeknek egy akut sérülés helyére kell bevándorolniuk. A véralvadás folyamatai is megváltoznak. A rovarok primitív immunrendszerében még kiemelt szerep jut azoknak az evolúciósan konzervált koagulációs folyamatoknak, amelyek szabályozatlan formában vérrögöket képeznek, és így stroke-ot vagy szívinfarktust okoznak a több krónikus betegséget is hordozó páciensekben. Ezen felül, a vérből és az agyi erek falával kapcsolatba lépő immunsejtekből származó gyulladásos faktorok hatására az agyi keringés romlik és a vér-agy gát integritása csökken. Diabeteszes, hiperlipidémiás, vagy atherosclerosisban szenvedő betegekben kimutatható a mikroglia sejtek megváltozott aktivitása is. Érdekes módon, a magas cukor, zsírsav vagy húgysav szintek direkt gyulladásos stimulust jelentenek a mikrogliának és a perifériás makrofágoknak is. Nem véletlen, hogy a fent említett betegségek (különösen több krónikus kondíció együttes jelenléte) egyszerre hozható összefüggésbe a pszichiátriai kórképek, a vérzéses vagy iszkémiás stroke, illetve a neurodegeneratív betegségek kialakulásával. Diabéteszben szenvedő betegeknél például gyakori komplikációnak számít a depresszió. Ugyanebben a betegcsoportban a stroke gyakorisága is emelkedett és kimenetele is súlyosabb, mint krónikus betegségben nem szenvedők esetén. Ennek oka részben az, hogy a stroke hatására kialakuló vér-agy gát sérülés és a beáramló immunsejtek mennyisége gyulladásos állapotban nagyobb, miközben a kapillárisok keringése romlik és megváltozik a mikroglia sejtek aktivitása is. A neurodegeneratív kórképek, mint az Alzheimer-kór esetén is egyre több adat áll rendelkezésre arról, hogyan változik meg az agyi keringés, a glia sejtek aktivitása vagy a gyulladásos folyamatok szabályozása.
Érdemes kiemelni, hogy mind a stroke, mind az Alzheimer kór gyakorisága nagymértékben nő az életkor előrehaladtával. Mind emberben, mind kísérletes állatmodellekben kimutatható, hogy az öregedés önmagában együtt jár az immunszervek (és az ezeket szabályozó idegek) csökkent működésével, miközben az immunfolyamatok szabályozása romlik, és számos szervben emelkedik a gyulladásos mediátorok szintje. Az idősödő agyban nem csupán fokozódik az idegsejtek degenerációja, de a glia sejtek, köztük a mikroglia aktivitása is megváltozik. Ezzel párhuzamosan hibás szerkezetű fehérjék (mint az amiloidok, a tau vagy az α-synuclein) halmozódnak fel, amelyek nem csupán az idegsejtek és az agyi keringés működését zavarják, de potens aktivátorai is a mikroglia sejteknek. Az agyi glimfatikus rendszer érdekes módon kiemelten fontosnak látszik az agyban felszaporodó metabolitok és hibás fehérjék eltakarításában, amelynek hatékonysága a közelmúltban végzett állatkísérletek szerint az öregedéssel és az amiloid fehérjék felszaporodásával párhuzamosan csökken. Érdekes módon a glimfatikus rendszer hatékonysága alvás során markánsan megnő, miközben a tartós kialvatlanság számos neurológiai betegséggel mutat összefüggést. Több megfigyelés mutatja azt is, hogy a fejlett társadalmakban a szervezet immunológiai státusza megváltozik. A fejletlen társadalmakban, ahol a parazitafertőzések gyakorisága nagy, az immunfolyamatok a parazitaellenes védekezésre vannak „hangolva” és ezzel párhuzamosan alacsonyabb a cukorbetegek aránya. Ma már tudjuk, hogy mind az 1-es, mint a 2-es típusú cukorbetegség kialakulásában gyulladásos fehérjék is fontos szerepet játszanak, amelyek termelődését a korábban átélt fertőzések, az életkor, a táplálkozás, a stressz és a bélbaktériumok összetétele is nagymértékben képes befolyásolni. Látható tehát, hogy számos párhuzamos folyamat kapcsolja össze az idősödő szervezet megváltozott gyulladásos folyamatait a szisztémás gyulladás és a krónikus betegségek kialakulásával, amelyek vélhetően komoly szerepet játszanak számos idegrendszeri betegség kialakulásában vagy súlyosbodásában.
Bár az elmúlt évtizedek során számos alapvető részletre derült fény az idegrendszeri betegségek kialakulásával kapcsolatban, mégis nagyon kevés áttörés született e betegségek gyógyításában. Konkrétan, az idegsejtek sérülését, halálát neuroprotektív drogok segítségével mérsékelni próbáló klinikai vizsgálatok a stroke, az Alzheimer-kór vagy Parkinson-kór kezelésére, sorra elbuktak. Ma már egyértelműnek látszik, hogy nem lehetséges az idegsejtek hatékony védelme az őket ellátó mikrokeringés és glia sejtek megfelelő állapotának fenntartása nélkül. Kiemelten fontosnak látszik az immun- és az idegrendszer kölcsönhatásainak átfogó megértése is. Ezek az önmagukban is rendkívül komplex interakciókra épülő rendszerek ugyanannak az evolúciós folyamatnak a termékei. Számos gyulladásos mediátor, amelyet az immunsejtek a kórokozókkal szembeni védekezésre használnak, termelődik az idegrendszerben is, de ott fiziológiás körülmények között a glia sejtek osztódását, vagy az agyi erek, gliális elemek és idegsejtek közti kommunikációt szabályozza. Az az IL-1, amelyik hasznos lehet a fertőzések elleni védekezésben, az immunsejtek aktiválása, a láz vagy a sickness behavior kialakítása révén, komoly károkat okozhat az agyban, ha termelődését a szervezet nem képes megfelelően szabályozni.
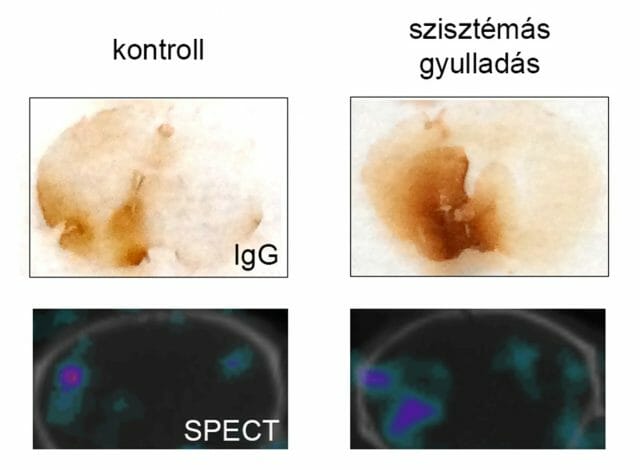
Ami némi reménnyel tölthet el bennünket, az a technológia fejlődése és a segítségével rohamtempóban gyarapodó ismeretanyag növekedése, amely korábban nem vizsgálható folyamatokba enged betekintést. A mára rutinszerűen alkalmazott proteomikai, transzkriptomikai és egyéb „omics” módszerek megmutatták, hogy a komplex biológiai rendszerek – köztük az idegi hálózatok működése és az immunfolyamatok – figyelemre méltó redundanciát és kompenzációs képességet mutatnak, ezért a folyamatok dinamikájának megértése nélkül nehezen képzelhető el ezek hatékony, külső szabályozása. Ez azonban bonyolultabb feladat, mint amilyennek elsőre látszik. Ezért a korábbinál jóval nagyobb hangsúly helyeződik a multidiszciplináris kutatásokra és különböző tudományterületek bevonására az idegrendszeri betegségek mechanizmusainak megértésében is.
A közelmúlt kutatásai például megmutatták, hogy az ún. inflammaszómák gátlásával, amelyek az IL-1 termelődését szabályozzák makrofágokban, endothelium sejtekben és mikroglia esetén is, nagymértékben mérsékelhetők a gyulladásos folyamatok a perifériás szervekben és az agyban is, és ezzel párhuzamosan gátolható az idegsejtek pusztulása, a kognitív képességek romlása a stroke vagy az Alzheimer-kór kísérletes állatmodelljeiben. Az IL-1 receptorokon keresztül történő jelátvitel gátlása ezen felül a szisztémás gyulladás hatására megnövekedett agyi károsodás visszafordításában is hatékony experimentális stroke-ot követően. A múlt tapasztalataiból okulva ugyanakkor nem indokolt a lelkesedés, mielőtt ezek az eljárások igazoltan hatékonynak bizonyulnak klinikai vizsgálatokban is (jelenleg több tucat, az IL-1 hatásainak gátlását célzó humán vizsgálat van folyamatban világszerte). A kutatóknak különösen óvatosnak kell lenniük, hogy ne vonjanak le elhamarkodott következtetéseket pontatlan, vagy a technológiai korlátok miatt nem kellően meggyőző vizsgálatokból, amelyek eddig is rendkívül sok fejtörést okoztak mind experimentális, mind a klinikai vizsgálatok esetén. Jó példa erre, hogy bár a mikroglia aktivációja és fokozott IL-1 termelése szinte minden idegrendszeri betegségben kimutathatók, a mikroglia szelektív eltávolítása az agyból markánsan megnöveli a kísérletes stroke okozta idegi károsodást, miközben hatékonynak látszik az Alzheimer-kór állatmodelljeiben tapasztalható memóriaromlás mérséklésében. Azaz a mikroglia által szabályozott folyamatok átfogó megértése nélkül nehezen képzelhető el az idegrendszeri betegségek hatékony terápiája.
Shakespeare korának embere még valószínűleg nem érezte a tudományos felfedezések hatására bekövetkező változásokat akkora horderejűnek, hogy azok félelemmel töltsék el, miközben Edgar Allan Poe korának gondolkodói joggal félhettek attól, hogy a fejlődés végül felismerhetetlenül átformálja az általuk ismert és féltett világot. Furcsa módon, az orvostudomány diadala a fertőző betegségek ellen és a rohamtempóban bekövetkező társadalmi változások újabb kihívások elé állították a modern kor emberét. Ezek közül az egyik legnagyobb valószínűleg az idegrendszeri betegségekkel szembeni hatékony küzdelem lesz, amelyhez érdemi segítséget csak a modern tudománytól várhatunk.
A cikk a Természet Világa 2018. októberi (149. évf. 10. sz.) számában jelent meg.


