A molekuláris élettudományok nem kisebb feladatra vállalkoznak, mint különböző élőlények, így az emberi szervezet biológiájának molekuláris szintű megértésére. Ezek a biológiai rendszerek mérhetetlenül összetettek, a bennük zajló folyamatok, valamint az ezekben résztvevő molekulák pedig olyan változatosak, hogy hatékony vizsgálatukhoz különböző tudományterületek létrejöttére volt szükség.
Közülük – időrendben haladva – a genomika az első, mely különböző szervezetek örökítőanyagának sokrétű vizsgálatával foglalkozik. A legtöbb embernek feltehetően a Humán Genom Projekt [1] kapcsán cseng ismerősen maga a szakkifejezés. Ennek az ezredfordulón átívelő, több mint egy évtizedes gigászi nemzetközi tudományos projektnek köszönhetjük, hogy sikerült feltérképezni a teljes emberi örökítőanyagot, annak több mint húszezer génjével együtt.
Ha azonban felidézzük a molekuláris biológia centrális dogmáját, azt, hogy az információ a DNS-ről az RNS-re, onnan pedig a fehérjékre terjed, akkor rögvest beláthatjuk, hogy az emberi biológia megismerése nem érhet véget a genomnál, valójában itt kezdődik csak el igazán.
Egy hétköznapi hasonlattal bemutatva: ha egy ház műszaki rajza a DNS, akkor az építésvezető, aki a tervrajz alapján irányítja az építkezést a hírvivő RNS, a munkához a téglát a transzfer RNS-ek szállítják a riboszomális RNS-nek, aki pedig felépíti a falakat, azaz a kész fehérjéket, amik aztán sokféle szerepet betölthetnek, például helyet adhatnak valamilyen üzemnek, vagyis biológiai folyamatnak (1. ábra).
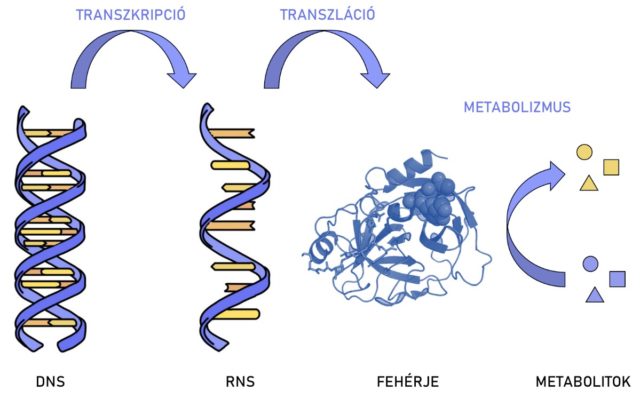
A genomika sikerén felbuzdulva sorra jöttek létre az újabb és újabb „omikák”, így többek között a transzkriptomika, proteomika, glikomika, metabolomika és lipidomika, melyek mind egy-egy biológiai szempontból fontos molekulacsoporttal foglalkoznak. Mivel a proteomikával és a glikomikával foglalkozom a Természettudományi Kutatóközpont MS Proteomika Kutatócsoportjában 2016 óta, most e két területbe nyerhetünk bepillantást.
A proteomika
A proteomika feladata egy szervezet fehérjeállományának vizsgálata, minőségi és mennyiségi viszonyainak, funkcióinak, kapcsolatainak felderítése. A fehérjék alkotják a természetben található legsokszínűbb biomolekulacsoportot funkcionális és szerkezeti szempontból is, az élethez nélkülözhetetlenek. A szervezetben betöltött szerepük szerint lehetnek például enzimek, hormonok, transzportfehérjék, motorfehérjék vagy strukturális fehérjék. Vizsgálatuk elengedhetetlen egyrészt a szervezet általános működésének, másrészt a
betegségek mechanizmusának megértéséhez.
Egy szervezet fehérjéinek vizsgálata több okból is hatalmas feladat. Egyrészt a vizsgálandó rendszer összetett: az eleve nagyszámú fehérje a génekről történő átíródás után általában még nem tudja betölteni a funkcióját, erre csak kisebb-nagyobb molekulák kapcsolódása után lesz képes, ami a komplexitást tovább fokozza. Másrészt az egyes proteinek mennyisége között hatalmas különbség is lehet, vérplazma esetén például akár tíz nagyságrendbeli. A vizsgált szervezet fehérjéinek kvalitatív és kvantitatív tulajdonságai függenek továbbá annak fiziológiás állapotától, tehát időben nem állandóak. Mindezen akadályok leküzdése egyetlen tudományágon belül nem lenne megoldható, ezért a proteomika szükségszerűen interdiszciplináris tudományág. Fontos szerepet kap benne a molekuláris biológia, az analitikai kémia, a bioinformatika és biostatisztika is.
A proteomikai vizsgálatok alapvetően két csoportba sorolhatóak. A célzott vizsgálatok valamilyen korábban már ismert, biológiai szempontból érdekes fehérje- vagy fehérjecsoport meghatározására irányulnak. Ezzel szemben a felfedezés hajtotta vizsgálatok minden komponenst egyszerre igyekeznek meghatározni, hogy így fényt derítsenek korábban még nem ismert összefüggésekre.
Az N-glikoziláció
Szervezetünkben nagy mennyiségben találhatóak különböző formában – akár magukban, akár komplex biomolekulák szerkezeti elmeként – cukrok (szacharidok), ezek vizsgálatával a glikomika foglalkozik. A szacharidokat tartalmazó molekulák biológiai szempontból talán legjelentősebb képviselői a glikoproteinek. Ezek olyan fehérjék, melyek meghatározott részeihez különböző oligoszacharid-szerkezetek, vagyis glikánok kapcsolódnak enzimatikus úton. Ezek a struktúrák igen sokfélék, összetettek lehetnek, a protein szerkezetét és tulajdonságait jelentős mértékben befolyásolhatják. Amennyiben a szacharid kapcsolódási pontja a fehérjéhez egy aszparagin aminosav, N-glikozilációról beszélünk. A glikozilációs helyek és az azokhoz kapcsolódó glikánok összességét glikozilációs mintázatnak nevezzük. Ez betegségek hatására jelentős mértékben átalakulhat, gyakori például a glikán láncon található fukóz és sziálsav egységek számának, valamint elhelyezkedésének megváltozása (2. ábra).
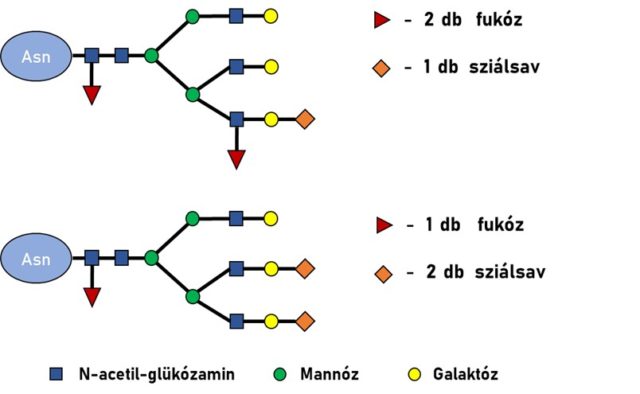
Az N-glikozilált proteinek vizsgálata kétféleképpen történhet, aszerint, hogy a két kémiailag jelentősen eltérő molekularészletet – a fehérjét, valamint az oligoszacharid-szerkezetet – elszakítjuk-e egymástól, vagy eredeti állapotukban vizsgáljuk. Ha a glikánokat a glikozilációs helyekről enzimek segítségével eltávolítjuk, akkor a mintánk összetettsége csökken, és a két molekulacsoport külön, célzottan vizsgálható. Ebben az esetben azonban elveszítjük a glikozilációs információ hely-specificitását, azaz nem fogjuk tudni pontosan megmondani, hogy adott glikozilációs helyhez mely glikánok milyen arányban kapcsolódtak. Olyan ez, mintha valaki egy sakkmérkőzésen számolná a leütött bábukat típusuk szerint, de a színüket nem írná fel. Így azt meg tudja mondani, hogy összességében milyen bábuból hány került ki a játékból, de azt nem, hogy ez hogyan oszlik meg a két játékos között. Ezzel ellentétben, ha a glikánt a glikozilációs helyről nem távolítjuk el, nemcsak átlagos, hanem részletes, a glikozilációs helyekreis kiterjedő információt kapunk. Vagyis a sakkmérkőzés hasonlatával élve, meg tudjuk mondani pontosan, hogy a játékosoknak milyen bábui vannak még a táblán, mi a játék pontos állása.
A prosztatarák diagnózisa
A rákos megbetegedések jelentős mértékben járulnak hozzá az éves halálozások számához, 2008 óta ez minden évben 27% felett van Magyarországon [2]. A daganatos megbetegedéseknek rengeteg típusa van, ezek különböző gyakorisággal fordulnak elő és eltérő mortalitással rendelkeznek (3. ábra).
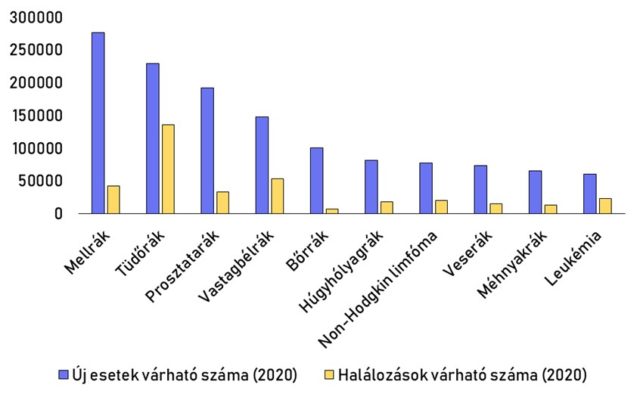
A prosztatarák a leggyakoribb daganatos betegségek egyike, minden kilencedik férfinél diagnosztizálják élete során. Mortalitása ezzel szemben a legtöbb rákos megbetegedéshez képest alacsony, az öt éves relatív túlélés 97,8%-os. Ez jelentős mértékben köszönhető a megfelelő szűrővizsgálatok meglétének. Ennek első lépése a vér PSA (prosztata-specifikus antigén) szintjének meghatározása, majd amennyiben ez emelkedett szintet mutat, további vizsgálatok következnek, mint a rektális digitális vizsgálat és ultrahang. Ezek közül az utolsó a mikroszkópos szövettani vizsgálat, ami alkalmas a végleges diagnózis felállítására.
A szövetminták osztályozására többféle rendszer is létezik, ezek a rákos és az egészséges sejtek arányát, illetve előbbiek megjelenését veszik figyelembe, így kategorizálva és számszerűsítve a betegség előrehaladottságát, illetve agresszivitását. Az egyes kategóriák (grádusok) közötti molekuláris különbségek meghatározása elengedhetetlen a prosztatarák kialakulásában és progressziójában szerepet játszó biológiai folyamatok feltárásához és megértéséhez. Ennek fontos eszközei a proteomika és a glikomika, mivel daganatos betegségek esetén a szövetekben jelen lévő fehérjék mennyisége, illetve glikozilációja jelentős mértékben megváltozhat.
Szövetek vizsgálata
Hogyan érdemes egy ilyen vizsgálatba belefogni? Mindenekelőtt el kell döntenünk, hogy milyen típusú mintákkal foglalkozzunk. A választásunk elsősorban azért esett a szövetmintákra a gyakran vizsgált vérplazma- vagy vizeletmintákkal szemben, mert utóbbiak összetételét a prosztatarákon kívül nagyon sok más élettani tényező is befolyásolhatja. A kísérletek megkezdéséhez tehát szövetmintákra van szükségünk, lehetőleg minél többre. A vizsgált minták száma ugyanis fontos jellemzője a vizsgálatoknak, minél több mintát (ebben az esetben egyént) vizsgálunk, annál nagyobb lesz a statisztikai erő, azaz annál kisebb különbségeket tudunk kimutatni megfelelő bizonyossággal. Olyan ez, mintha valaki szeretne egy új bútordarabot elhelyezni a lakásában, de a rendelkezésre álló hely nagyon korlátozott lenne. Minél kisebb a különbség az elhelyezendő tárgy és a számára kijelölt hely mérete között, annál többször (és annál nagyobb műgonddal) húzzuk ki a mérőszalagot, hogy biztosak legyünk a dolgunkban. Arra is fontos ügyelni, hogy az összehasonlítani kívánt csoportok mindegyikéből legyen elegendő számú mintánk. Ez például prosztatarák vizsgálata esetén nem mindig könnyű feladat, ugyanis a betegség korai szakaszában ritkán vesznek biopsziát, azok túlnyomó többsége előrehaladott állapotú tumorokból származik.
Ha sikerült megfelelő mennyiségű mintához jutnunk, kezdődhet a labormunka. A kutatócsoportban kifejezetten kis mennyiségben rendelkezésre álló szövetminták hatékony glikomikai és proteomikai vizsgálatára fejlesztettünk egy mintaelőkészítési módszert (4. ábra).
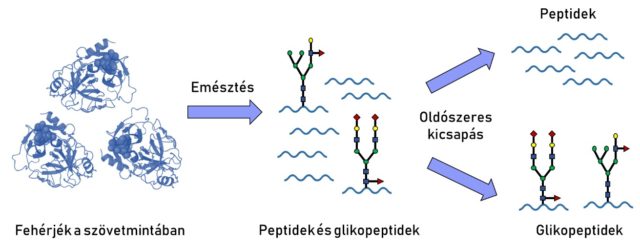
A mintaelőkészítés első lépése az emésztés. Ennek a célja az, hogy a nagy méretű fehérjéket kisebb darabokra – peptidekre, illetve glikopeptidekre – hasítjuk fel enzimek segítségével. A folyamathoz az ötlet a természetből származik, hiszen hasonló folyamat játszódik le a szervezetünkben is. A hasnyálmirigy által termelt tripszin nevű proteáz (vagyis fehérjebontó enzim), illetve annak sertések által termelt változata a proteomikai vizsgálatok leggyakrabban használt enzime. Mivel az emésztés során használt reagensek egy része a későbbi műszeres vizsgálatot zavarhatná, ezt egy tisztítási lépés kíséri.
Ezután következik a módszer központi eleme, az oldószeres kicsapás. Ez két részre osztja a mintáinkat: az egyikben – pellet formájában kicsapódva – feldúsulnak a glikopeptidek, a másikban pedig – oldott állapotban maradva – a nem-glikozilált peptidek. Erre a lépésre azért van szükség, mert a szervezetben a glikoproteinek relatív mennyisége a glikozilálatlan fehérjékhez képest igen alacsony, így egymás melletti vizsgálatuk nehézkes. Ezzel véget is ért a mintaelőkészítés, következhet a glikopeptidek és peptidek műszeres vizsgálata.
A műszeres vizsgálathoz UHPLC-MS készüléket használunk, mely két nagyobb szerkezeti elemből épül fel, egy ultranagy hatékonyságú folyadékkromatográfból (UHPLC) és egy tömegspektrométerből (MS) (5. ábra).
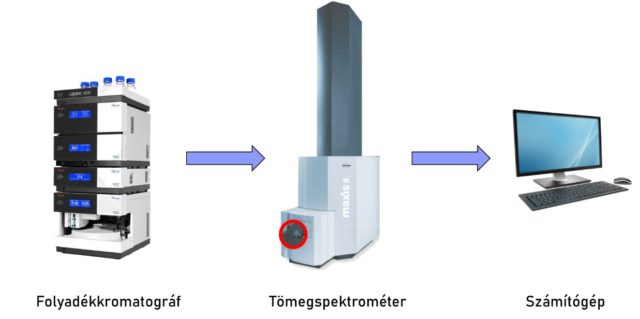
A folyadékkromatográf feladata, hogy a mintákban található komponenseket időben elválassza egymástól valamilyen tulajdonságuk alapján (ez esetünkben a molekula hidrofobicitása). Az elválasztott komponensek ezután bekerülnek a két nagy szerkezeti elemet összekötő egységbe, az ionforrásba, mely gázfázisú ionokat képez belőlük, majd a tömegspektrométerben detektálódnak molekulatömeg/töltés (m/z) hányadosuk alapján. Amennyiben összetett minták vizsgálata a célunk – mint például a prosztataszövet – nem elegendő az egyszerű detektálás, mert minél több komponenst vizsgálunk egyszerre, annál valószínűbb, hogy kettőnek véletlenül megegyezik az m/z értéke. Ebben az esetben úgynevezett tandem tömegspektrometriás mérésekre van szükség. Ez azt jelenti, hogy komponenseinket fragmentáljuk, vagyis kisebb darabokra szakítjuk, majd ezeket is detektáljuk tömeg/töltés hányadosuk alapján. Mivel egy molekula fragmentációja függ annak szerkezetétől, abból strukturális információ nyerhető. Olyan ez, mintha egy egyszerű és egy edzett üveglapot szeretnénk megkülönböztetni egymástól. Ránézésre nem lehetséges, de ha töréstesztet végzünk rajtuk, rögtön megbizonyosodhatunk róla, hogy „ki kicsoda”, mert másképpen hasadnak darabokra.
A peptidek és a glikopeptidek műszeres vizsgálata nem ugyanazzal a módszerrel történik. Ennek oka a fragmentációs sajátságaikban keresendő. A glikopeptidek peptid gerincéről nagyon könnyen – alacsony energián – lehasadnak az oligoszacharid-láncok, a peptid rész viszont lényegében érintetlen marad. Ezért ebben az esetben kevert energiát használunk, azaz készítünk alacsony és magas energiájú felvételeket is, így mindkét molekularészletről nyerhetünk információt. Peptidek vizsgálata esetén erre nincs szükség.
A műszeres vizsgálatok hatalmas mennyiségű adatot termelnek, manuális feldolgozásuk elképzelhetetlenül sok időt venne igénybe, ezért erre a célra különböző bioinformatikai eszközöket, szoftvereket, algoritmusokat használunk. Az adatok értékelésének két jól elkülöníthető lépése van, az első az adatbáziskeresés. Ennek célja a mintákban található fehérjék, illetve glikozilációs helyek azonosítása és mennyiségük meghatározása a mérési adatok referencia-adatbázishoz való hasonlításával. Az adatbáziskeresés után következnek a különböző összehasonlító vizsgálatok. Ezek során statisztikai módszerek segítségével igyekszünk fényt deríteni a vizsgált – ebben az esetben egészséges és prosztatarákos – csoportok közötti különbségekre.
A 6. ábrán két összehasonlítható vizsgálat eredménye látható a prosztataszövetekben azonosított fehérjék mennyiségi adatai alapján.
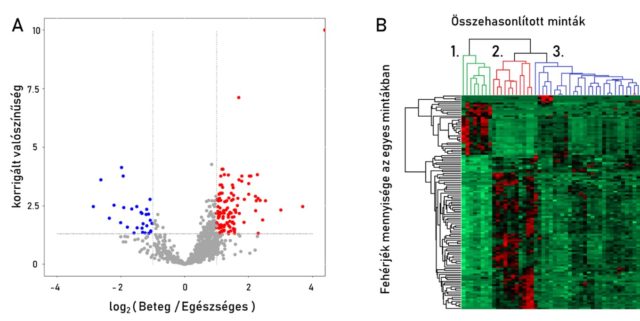
A 6/A ábrán egy úgynevezett Volcanoplot látható, melyen minden pont egy külön proteint jelöl. A vízszintes tengely azt mutatja meg, hogy a rákos szövetekben a fehérjemennyiség hogyan változik az egészséges szövetekhez képest. Minél távolabb kerülünk a nullától, annál nagyobb a változás mértéke, negatív irányba nő, pozitív irányba pedig csökken. A függőleges tengely annak a valószínűségéről ad tájékoztatást, hogy a két csoport között van-e tényleges különbség. Minél feljebb haladunk rajta, annál biztosabbak lehetünk ebben. A piros és kék pontok azokat a fehérjéket jelölik, melyekről nagy megbízhatósággal sikerült megállapítani, hogy mennyiségük jelentős mértékben nő (piros) vagy csökken (kék). A 6/B ábrán egy heatmap látható, mely a különböző grádusok között szignifikánsan változó fehérjék mennyiségét mutatja színek formájában. Minél távolabb van az adott mintában mért érték az átlagostól, annál intenzívebb a cella színe, alacsonyabb érték esetén zöld, magasabb érték esetén vörös. A heatmap készítésekor az algoritmus a hasonló mintákat (vízszintes tengely) és a hasonló fehérjéket (függőleges tengely) egymás mellett ábrázolja, így ezek csoportokba fognak rendeződni. Az egymástól legjobban elkülönülő három mintacsoport (az ábrán külön színnel és sorszámmal jelölve): 1.: zöld – egészséges szövetek, 2.: piros – 3. grádus (gyorsan szaporodó rákos sejtek), 3.: kék – 2. és 1. grádus (kevésbé gyorsan és lassan szaporodó rákos sejtek). Ez arra enged következtetni, hogy proteomikai szempontból a grádusok között jelentős molekuláris különbségek vannak.
Tovább erősítik ezt a feltételezést a glikomikai eredmények is. Több, rákos folyamatban központi szerepet játszó protein glikozilációs mintázata jelentős változást mutat, legnagyobb mértékben a sziálsav egységek számában. Ilyen például a biglikán, ami a legfrissebb kutatások szerint több ráktípus diagnózisában és prognózisában is segíthet a jövőben [4], valamint a kollagén, mely hatással van a tumor prognózisára, esetleges kiújulására és rezisztenciájára is [5].
A tudomány azonban itt nem áll meg. A csoportok közötti különbségek ismeretében azonosíthatjuk, hogy milyen biológiai folyamatok zajlanak a háttérben, meg tudjuk mondani, hogy melyek aktiválódnak, vagy éppen gátlódnak. Így megállapíthatjuk, hogy melyek a prosztatarák hajtórugói, és új, megbízhatóbb szűrésre alkalmas molekulákat jelölhetünk ki, vagy akár eddig nem ismert terápiás lehetőségeket is felfedezhetünk. Ezeknek a folyamatoknak a meghatározására és vizualizációjára számos lehetőségünk van, közös bennük az, hogy valamilyen hálózatot építenek a fehérjékből, illetve az őket kódoló génekből. A 7. ábrán látható fehérjehálózat azokat a fehérjéket tartalmazza, melyeknek az 6/B ábrán található heatmap alapján megnő a mennyisége a 3. grádusba tartozó szövetminták esetén. A pirossal megjelölt fehérjék mindegyike részt vesz a fehérjeszintézis folyamatában, ez a folyamat a prosztatarák előrehaladásával aktiválódik.
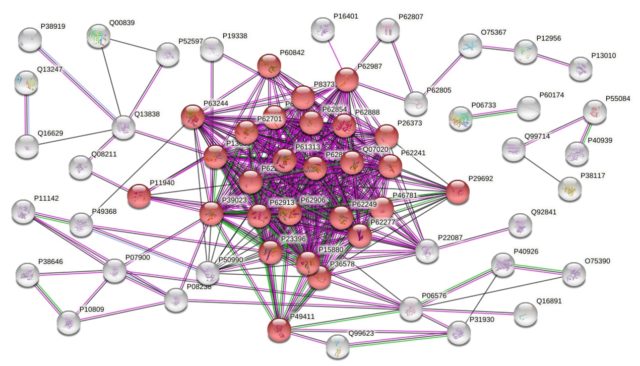
STRING-hálózat, megjelölve a fehérjeszintézisben résztvevő proteineket
Természetesen a fehérjék és glikoproteinek vizsgálata nem rántja le a leplet az összes háttérben húzódó biológiai folyamatról – elvégre az emberi szervezet egy hihetetlenül összetett rendszer –, mégis közelebb visz a valóság megismeréséhez. De éppen ebben rejlik az alapkutatás szépsége: ha nem is mi leszünk azok, akik felfedezik a „rák ellenszerét”, ezt a modern kori bölcsek kövét, a kutatás közben valahol, valamikor hozzátehetettük a magunk részét.
SUGÁR SIMON NÁNDOR
A cikk a TIT és a DOSZ ismeretterjesztő cikkpályázatán I. díjat nyert.
IRODALOM
[1] The Human Genome Project: lessons from large-scale biology – Science, 2003, 300.5617: 286-290.
[2] Halálozások a gyakoribb halálokok szerint – Központi Statisztiai Hivatal adatai https://www.ksh.hu/
[3] A National Cancer Institute adatai alapján – https://seer.cancer.
[4] Biglycan as a potential diagnostic and prognostic biomarker in multiple human cancers – Oncology Letters, 2020, 19.3: 1673-1682.
[5] The role of collagen in cancer: from bench to bedside – Journal of translational medicine, 2019, 17.1: 309.
A cikk a Természet Világa 2021. februári számában (152. évf. 2. sz.) jelent meg.


