A növények életét számos élő és élettelen környezeti tényező befolyásolja. Élő faktorok a vírus- és gombafertőzések, valamint a növényevő állatok általi károsítás. Fontosabb élettelen faktorok a hőmérséklet, a víz- és tápanyag-ellátottság, a fény vagy a szennyezőanyagok. Ezek a tényezők a növény környezetében adott skálán fordulnak elő, és fajonként eltérő az a tűrési tartomány, amely a növény számára optimálisnak bizonyul. Ezt az ökológiából jól ismert haranggörbe csúcsa az optimális, az ettől balra és jobbra eső görbe alatti terület a szub- és szupraoptimális (optimum alatti és feletti) tartományokat, a görbe szélei pedig a minimum és maximum tűrést mutatják. Adott környezeti tényező minden növény esetén más és más tartományban hat optimális szinten.
Amikor legalább egy környezeti tényező az optimális tartományon kívül hat egy adott növényre, az stresszhatásként fogható fel. A stressz a növény – és általában az élőlények – számára kedvezőtlen fejlődési körülményeket biztosít. A hatás erőssége és időtartama nagyban befolyásolja az egyed túlélő képességét. Egy megfelelő ideig tartó gyenge stressz (eustressz) konstruktív hatású is lehet a növényre. Ekkor az anyagcsere-folyamatok a védekezés támogatásának irányába tolódnak el. Utóbbi állapotot edződésnek, idegen szóval akklimatizációnak nevezünk. Ha egy stresszfaktor túlságosan intenzív vagy hosszú ideig tart, akkor a növény ugyan megpróbálja a védelmet kialakítani, de ennek hatékonysága gyakran túl alacsony, ami lassítja a növekedés és fejlődés ütemét, végeredményeképpen az egyed szaporodásra való rátermettségét – más szóval a fitness-t.
A fotoszintézis és szakaszai
A fotoszintézis a földi élet alapja. Kiemelkedően fontos jelenség, mivel naprendszerünk központi csillaga, a Nap által kibocsátott elektromágneses sugárzás energiáját a növényeket alkotó szerves vegyületek kémiai kötéseibe építi be, amely energia az életfolyamatok alapja. A fotoszintetikus reakciók két nagyobb csoportba sorolhatók: fény- és sötét szakasz. Utóbbi fő eleme Calvin-ciklus néven is ismert, és alatta történik a szénhidrátok és cukrok bioszintézise. Reakciói szintén megvilágítás alatt zajlanak, azonban a kémiai szintézis reakciók számára a fény hatása közvetlenül nem fontos. A fényszakasz reakciói során történik a víz bontása oxigén szabadgyökök képződésén keresztül molekuláris oxigénre, valamint protonokra (H+) és elektronokra, amelyek felhalmozódása energiaképződéshez nyújt alapot a növényi sejt számára. A protongrádiens (elektrokémiai potenciál) egyrészről kémiai koncentrációkülönbség (H+, hidrogénion), másrészről az elektromos töltés miatt potenciálkülönbség (feszültség) formájában raktározódik, amely az erre a célra kialakult speciális molekulák közreműködésével szerves vegyületek kötési energiájává alakul. Ennek a nagy energiájú (makroerg) kötési energiának a felszabadulása szolgáltatja az alapot a szénhidrátszintézis, valamint számtalan más biokémiai reakció energiaigényének fedezésére.
Az elnyelt fény hasznosítása
A fényszakasz folyamatainak gyorsaságát a növény általános állapota, vagyis az optimális és kedvezőtlen tartományban ható környezeti tényezők eredője határozza meg. A fotoszintézis szempontjából a legfontosabb élettelen környezeti tényezők a vízellátottság, a megvilágítás és a hőmérséklet. Ezek hiánya vagy túlkínálata külön-külön is lassítja a folyamatok sebességét, együtt azonban hatványozottan rontja a fotoszintézis hatékonyságát. A fény hasznosulása szempontjából talán mégis a megvilágítás erőssége [fényintenzitás, fotoszintetikusan aktív foton fluxus denzitás (PPFD) = μmol foton/m2 felület/sec)] a legfontosabb. A növény által elnyelt egységnyi fénymennyiség (kvantum) optimális környezeti körülmények között biztosítja a megfelelő növekedést és fejlődést. Ekkor a levélsejtekben található zöld színtestekben (kloroplasztisz) a fény hatására a vízbontás zavartalanul zajlik, a vízből keletkező proton- és elektronképződés sebessége és az őket felhasználó biokémiai reakciók felhasználása egyensúlyban van. Amennyiben a környezeti tényezők nem megfelelő tartományban hatnak az egyedre, akkor a normális növekedési körülmények alatti egyébként optimális fényintenzitás károssá válhat a növény számára. Ennek oka, hogy stressz körülmények között a biokémiai reakciók lassabban mennek végbe, a képződött protonok és elektronok felhasználása korlátozottabb ütemű. Ez figyelhető meg például a hőmérséklet csökkenése esetén. Szuboptimális hőmérsékleti körülmények között a legtöbb biokémiai reakciót katalizáló fehérje, más szóval enzimek működése (aktivitása) lelassul. Ez előbbit tetőzi a vízbontásból folyamatosan képződő reaktív oxigénformák (Reactive Oxygen Species, ROS) szintjének emelkedése, amelyek a sejthártyát, a fehérjéket és az örökítő anyagot (DNS) egyaránt károsítják. A zöld színtestben lévő fényelnyelésre és a vízből képződött elektronok vezetésére alkalmas molekuláris lánc (elektrontranszport lánc) túltelítetté (redukált állapotúvá, azaz elektronban gazdaggá) válik, és nem képes a folyamatosan zajló, fény által katalizált vízbontásból származó újabb elektronok továbbítására. Ekkor egyfajta rövidzárlat lép fel. Más hasonlattal élve nagyobb az elektronkínálat, mint a kereslet.
A fényenergia elnyelése és felhasználása közötti egyensúly helyreállítása érdekében és a káros ROS képződése ellen a növény igyekszik a fényenergia többletet különféle utakon leadni. Az úgynevezett energiamentesítő, idegen szóval disszipációs folyamatok mindegyike a túlzott mértékű gerjesztési energia közömbösítésében játszik szerepet. A gerjesztési energiatöbblet disszipációjának mértékével fordított arányosságban áll a fotoszintézis hatásfoka, amely jelentős tényező a növények növekedése és fejlődése, gazdasági növények esetén pedig a terméshozam szempontjából. Vizsgálata egyik elsődleges eszköze a növényélettani és stresszvizsgálati kutatásoknak. Az alábbi egyenlet egységnyi elnyelt foton energiájának sorsát írja le.
Y(II) + Y(NPQ) + Y (NO) = 1
Az egyenlet Y(II) tagja a fényenergia fotoszintetikus reakciókra jutó (hasznos) részét jelenti. Ez az úgynevezett aktuális kvantumhatásfok. Az Y(NPQ) a szabályozott, a xantofillok biokémiai reakcióihoz és a zöld színanyag (klorofill) szerkezeti átalakulásaihoz köthető hő-, illetve más sugárzások útján történő többletenergia-leadást jelent. Az Y(NPQ) értéke akkor emelkedik meg, amikor a növényt rövidebb idejű, enyhébb, visszafordítható károsodás éri. A harmadik tag, az Y(NO) az erős és tartós károsodások esetén jellemző többletenergia mentesítési utakat foglalja magába. A három változó egymástól való eltérésének aránya információt nyújt a növény eltérő környezeti körülmények közötti fényhasznosítási és ellenálló képességéről (1. ábra).
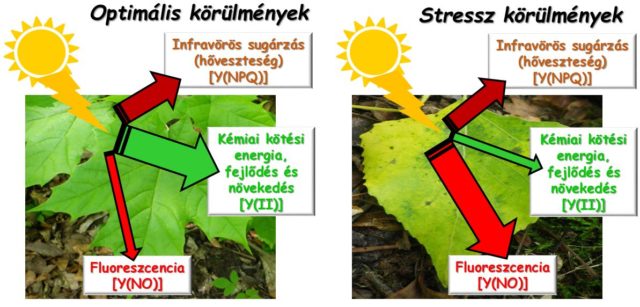
Láthattuk, hogy kedvezőtlen környezeti körülmények között az egyébként normál fényintenzitás magasnak bizonyulhat a növény számára. A zöld színtestekben lévő, fényelnyelésre képes klorofill molekulák túltelítődnek (erősen redukált állapot). A lelassult biokémiai reakciók alacsony elektronigénye miatt a zöld színtestekben elektronok (és protonok) halmozódnak fel, amely az asszimiláció hatásfoka szempontjából kedvezőtlen állapot. A növény a többletenergia egy részét fluoreszcens sugárzás útján igyekszik semlegesíteni. Ebből következik az a fontos tény, nevezetesen a kibocsátott fluoreszcencia erőssége (intenzitása) összefüggést mutat a stressz mértékével. A klorofillmolekulák fluoreszcenciája műszeresen mérhető, és annak alapján történik a kvantumhatásfok számítása, amelynek megértéséhez néhány alapfogalom ismerete szükséges.
A klorofillmolekulák gyenge megvilágítás alatt is kibocsátanak egy alacsony intenzitású alap fluoreszcenciát (fluoreszcencia: F, alap fluoreszcencia: F0). Primer fotoszintetikus esemény bekövetkezéséhez megfelelő intenzitású, úgynevezett aktinikus fényhatás szükséges. Aktinikus megvilágítás alatt a klorofillok pillanatnyi fluoreszcenciája mérhető (Ft). A sötétadaptált levélben a fotoszintézis működését szolgáló redukciós és oxidációs változásokra érzékeny molekuláris rendszer erős fényhatásra (telítési fény) akkora terhelést kap, ami elektronokkal túltelíti annak résztvevőit (teljesen redukált állapot). A telítési megvilágítás alatt a hirtelen fényterhelés miatt egy nagymértékű, mentesítő hatású fluoreszcens sugárzás mérhető, ami maximális fluoreszcencia hozam (Fm) néven ismert. A hangsúly a fluoreszcencia túlzott megvilágítás elleni mentesítő hatásán van.
A fényhasznosulás vizsgálata
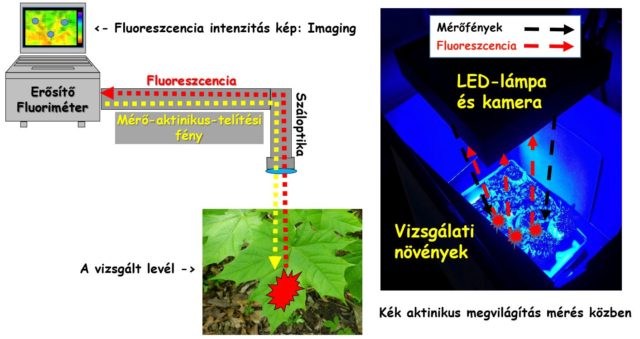
A növényi fluoreszcenciát szabályozható, mesterséges fénnyel vizsgáljuk, a módszer neve: klorofill-a fluoreszcencia indukció (FI). A mérés eszköze a fluoriméter, amely képes előzetesen beállított mérőfényt kibocsátani, valamint a megvilágítással párhuzamosan a klorofill fluoreszcenciáját érzékelni. A fluoreszcencia intenzitását növényekben már jó néhány évtizede képesek vagyunk mérni, azonban az áttörést a PAM (Pulse Amplitude Modulation) technológia felfedezése és bevezetése hozta el az 1980-as években. A PAM technika újdonsága a korabeli módszerekkel szemben abban rejlik, hogy a fluoreszcenciát indukáló mérőfény és ebből következően a levél által kibocsátott fluoreszcencia is amplitúdó-modulált, így a kapott jel jobban elkülöníthető hasonló karakterisztikájú egyéb sugárzásoktól, amelynek fontos szerepe van a mérés pontossága és a gyakorlati alkalmazások használhatósága szempontjából.
A mérés sötétadaptált leveleken történik. Ez azt jelenti, hogy a mérés előtt a levelet 15-20 percig sötétben tartjuk, ami azért fontos, hogy a zöld színtestekben lévő fényelnyelő rendszer molekuláinak elegendő ideje legyen arra, hogy az elektrontranszport működése révén elektronmentessé (vagyis: teljesen oxidált állapotúvá) és maximális fogadóképességűvé váljanak a vízbontásból származó elektronok fogadására. A fluoreszcencia kioltási (quenching) analízishez szükséges mérő-, aktinikus és telítési fényt a mérőműszerbe épített LED fényforrások biztosítják. Az F0 érték meghatározásához 1 μmol/m2/sec alatti intenzitású kék fényt (λ=450 nm) használunk, majd egy 0,5-1 másodperc időtartamú, PPFD: 4000-6000 μmol/m2/sec telítési fényfelvillanás (flash) alkalmazásával meghatározzuk az Fm értékét. Az F0 és Fm ismerete alapján meghatározható a fotokémiai rendszerek maximális kvantumhatásfokát leíró Fv/Fm paramétert (Fv: változó fluoreszcencia, Fv=Fm-Fo). Az Fv/Fm alapvető információt nyújt a növény károsodottságáról. Átlagos értéke egészséges növényben 0,79-0,84 körüli, ami a fényelnyelő és energiatovábbító molekuláris fotokémiai rendszer közel sértetlen állapotára utal. Hasonlóan más hatásfok- paraméterekhez, mértékegysége nincs. 0,79 alatti maximális kvantumhatásfok a növény enyhébb-súlyosabb károsodására utal. Teljesen elpusztult levélen mért Fv/Fm érték általában a nullához közelít.
A megvilágítás alatti aktuális kvantumhatásfok megállapításához az Fv/Fm meghatározását követő rövid sötét periódus (lag time, 30-60 másodperc) következik, amely elegendőnek bizonyul az elektrontranszport lánc újbóli nyitott állapotba kerüléséhez (az Fm meghatározását követő teljes redukált állapot utáni ismételt oxidált állapot). Fajtól és kísérlettől függően a levelet ekkor hosszabb ideig tartó (10-20 perc esetleg hosszabb idejű) aktinikus fénnyel (néhány száz μmol/m2/sec fényintenzitás) világítjuk meg, ami elindítja a víz bontását, ezáltal protonképződést és elektronáramlást. Az aktinikus fény bekapcsolásával megtörténik Fm’ meghatározása (Fm’: maximális fluoreszcencia hozam fényadaptált állapotban). A 10-20 percnyi aktinikus megvilágítás alatt 20-60 másodpercenként a fentebb említett rövid idejű és magas intenzitású telítési fényt alkalmazunk. Eközben a folyamatosan világító kisebb intenzitású aktinikus fény fokozatosan kioltja (csökkenti) a klorofill molekulák által kibocsátott fluoreszcenciát. Legvégül beáll a fotoszintézis fajra és anyagcsere-állapotra jellemző állandósult állapota (steady state).
Az ebben szakaszban mért fluoreszcencia és az ennek alapján kiszámolt, a fenti egyenletben bemutatott Y(II), Y(NPQ) és Y(NO) kvatumhatásfok (vagyis: a foton energiájának hasznosulását leíró) paraméterek egymáshoz viszonyított aránya fontos információ a fotoszintetikus kapacitásáról. A 2. ábrán a fluoriméter által mért fluoreszcenciahozam alapján számolt három kvantumhatásfok-paraméter színes képeken megjelenített időbeli változása (kinetikája) látható. Mindemellett a fluoreszcencia kioltódásának (megszűnésének) sebessége is jól tájékoztat a fotoszintézis működőképességéről. Egy muskátli (Pelargonium zonale L.) leveleken elvégzett quenching analízisből származó kísérleti görbe a 2. ábra alsó részén látható.
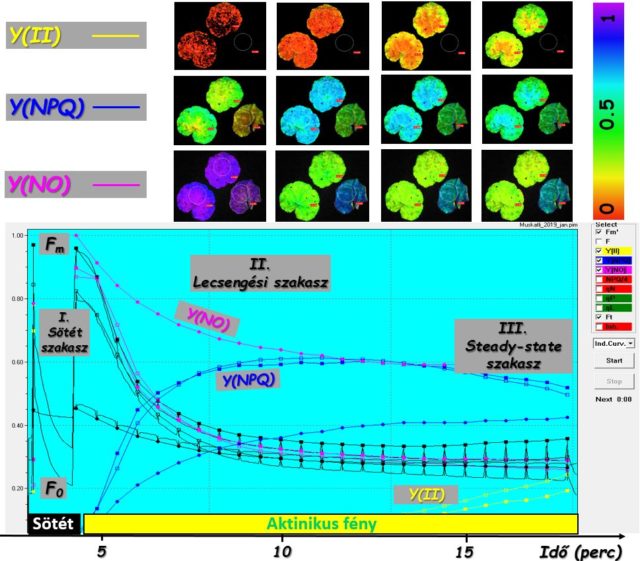
Évtizedekkel ezelőtt elsőször az analóg fluoriméterek és mérőkészülékek jelentek meg. Napjainkban a korszerű, digitális műszerek és képalkotó (Imaging) technológiák egyre inkább elterjedtnek számítanak. Ezek a mérés során az egész levél felületéről készítenek felvételt, amelyet számítógép segítségével színes fluoreszcencia intenzitás képként tesznek láthatóvá (3. ábra). A mérés alatt műszer CCD kamerája segítségével beállítható gyakoriságú időbeli sorozatfelvételt készít, majd elmenti azokat. A képek az elmentett mérési fájlból megnyithatók és újra elemezhetők. Ezeken a színes fotókon jól megfigyelhető a fluoreszcencia intenzitásának eloszlása (heterogenitása) a levél felületén, ami a régebbi műszerekkel szemben jelentősen segíti az eredmények pontosabb kiértékelését a kutatók számára. A képekből nyert számadatok és időbeli görbék alapján megállapíthatók a kvantumhatásfok és a gerjesztési többletenergia levezetését kifejező paraméterek különbségei, időbeli változása, amelyek számtalan növényélettani kérdés tisztázásához járulnak hozzá.
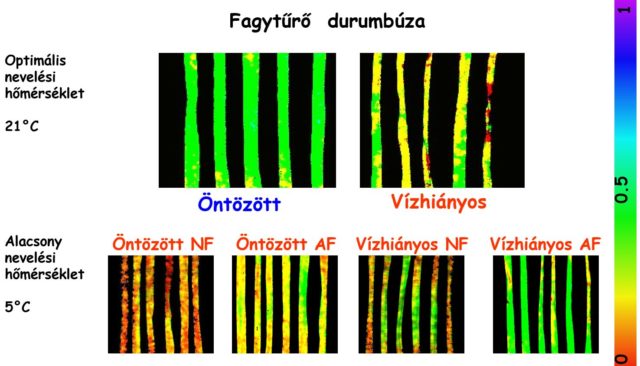
Lássunk egy érdekes növényélettani megfigyelést, amelynek bemutatásához a FI analízis hasznos eszközként használható! Ahogy a fentiekben láttuk, a fotoszintézis fényszakaszának működését jól jellemzi az aktuális kvantumhatásfok [Y(II)]. A szárazság enyhe és súlyos esetben is csökkenti a fotoszintézis hatékonyságát. Legalábbis normál hőmérsékleti körülmények között. Ez a tény meglehetősen általános a növényvilágban. Kutatásaink alapján ez a kérdés azonban más megvilágításba is kerülhet. Ellenőrzött körülmények alatt mérsékelt vízmegvonásnak kitett durumbúza növények alacsony hőmérsékleten ugyanis a normális tartományba eső Y(II) értékeket mutattak az öntözött állománnyal szemben. Itt fontos hangsúlyozni, hogy alacsony, azaz szuboptimum hőmérsékleten történik ez a jelenség. A fényerősség csökkentése, illetve annak a mérsékelt vízmegvonással való kombinált alkalmazása ugyancsak javította az aktuális kvantumhatásfok értékét. A legalacsonyabb értékek az öntözött és erősebb megvilágítású populációban voltak megfigyelhetők (4. ábra). További kutatást igényel, hogy a javító hatású jelenség vajon hidegre érzékeny zöldségnövényekben is létezik-e? Ha igen, akkor esetleges alkalmazása segíthet a szezonon kívüli zöldségtermesztésben alacsonyabb fűtési költséget eredményezve. Ehhez azonban megfelelő, szabályozható klímájú, precíziós öntözőrendszer és ellenőrző műszerek lesznek szükségesek.
A fluoreszcencia indukció alkalmazási lehetőségei
A klorofill fluoreszcencia indukciós mérést eredetileg csak néhány biofizikai laboratóriumban használták. Régebben gyakran saját készítésű műszerek voltak. Napjainkban már jó néhány műszergyártó forgalmaz mérésre alkalmas egységes fluorimétereket. A technika jövője a fenotipizáló rendszerek egyre szélesebb körű elterjedése során teljesedhet ki. Ezek a konstrukciók többféle kamerát és mérőegységet tartalmaznak – a fluorimétert is beleértve. Üvegházi vagy szántóföldi növényállományok állapotának folyamatos ellenőrzésére alkalmasak, automata működésűek, adatrögzítésük és feldolgozásuk nagy kapacitású informatikai háttérrel támogatott. Elterjedésük a mezőgazdaságban még nem igazán jellemző, azonban a termelés hatékonyságát fokozó egyik eszközként fokozatos térhódításuk várható.

Érdekes, használható eredményekről számoltak be az alma automatizált, nagyüzemi termésérés vizsgálata során. A fejlődő, éretlen termés ugyanis még több klorofillt tartalmaz, amely az érés során fokozatosan lebomlik. A klorofill fluoreszcencia intenzitásának mértéke alapján következtetni lehet a gyümölcs minőségére és érettségének állapotára, ezáltal a gépsoron történő szortírozás hatékonyabbá válhat a kereskedelem számára.
Az eddigieket összefoglalva, a FI indukciós vizsgálat a kutatási alkalmazások mellett fenotipizáló rendszerek részeként fontos eszköze lehet a növény szemmel nem látható fejlődési rendellenességeinek korai felismerésében, amely hozzájárul a termesztett növények hatékonyabb tápanyag utánpótlásához és betegség megelőzéséhez.
MAJLÁTH IMRE
A cikk a Természet Világa 2020. augusztusi számában (151. évf. 8. sz.) jelent meg.





